S’il est bien connu que le diabète peut se compliquer sur le plan micro et macrovasculaire (complications pour lesquelles un dépistage est organisé et systématique), un surrisque de cancer a été identifié chez les patients diabétiques. De plus en plus de données suggèrent que le diabète pourrait participer à la carcinogenèse, mais des incertitudes persistent quant au mécanisme physiopathologique.
Résumé
Des études épidémiologiques indiquent une augmentation du risque de cancer pour plusieurs localisations, ainsi que de mortalité par cancer, chez les patients diabétiques versus non diabétiques. Cette association diabète et cancer nécessite une attention clinique particulière, malgré l’absence de recommandation spécifique pour le dépistage du cancer chez ces patients. Les mécanismes physiopathologiques qui sous-tendent ce lien diabète-cancer restent incertains et des études supplémentaires sont nécessaires. S’il a été suggéré que les médicaments antidiabétiques pouvaient exercer une influence sur le risque de cancer (négativement, voire positivement pour la metformine), différentes associations scientifiques américaines (ADA/ACS/AACE/ACE) ne retiennent actuellement pas d’effets tumoraux propres amenant à revoir leur usage en pratique clinique courante, et aucun essai clinique randomisé n’a confirmé un effet protecteur de la metformine. Malgré ces incertitudes persistantes, corriger les facteurs de risque environnementaux modifiables est un point essentiel.
Abstract
Diabetes and cancer, the point in 2023
Epidemiological studies indicate that the risk of cancer for several sites, and the risk of cancer mortality, are increased in diabetic versus non-diabetic patients. This association between diabetes and cancer requires a special clinical attention in these patients, despite the absence of specific recommendations for cancer screening. The pathophysiological mechanisms underlying this diabetes-cancer association remain unclear and further studies are needed. Although it has been suggested that antidiabetic drugs may have an influence on cancer risk (negatively, or even positively for metformin), different American scientific associations (ADA/ACS/ACE/ACE) do not currently consider any specific tumour effects that would lead to a modification of their use in routine clinical practice, and no randomized clinical trial has yet confirmed a protective effect of metformin. Despite these persistent uncertainties, correcting modifiable environmental risk factors is an essential point.
Introduction
Avec une prévalence en augmentation (1), le diabète se définit par une hyperglycémie (≥ 1,26 g/l) chronique. Le diabète de type 2 (DT2) est secondaire à une insulinorésistance et à un hyperinsulinisme réactionnel évoluant vers une insulinopénie relative, tandis que le diabète de type 1 (DT1) est secondaire à une insulinopénie absolue (2). Le diabète est associé à une augmentation du risque de morbidité cardiovasculaire et non cardiovasculaire, telle que le cancer. Le cancer est responsable d’une mortalité précoce plus élevée chez les patients diabétiques que dans la population générale (3).
Une fréquence de certains cancers plus élevée
Les patients atteints de DT2 présentent un excès de risque de cancer de +20-25 % : notamment du sein, du côlon, de l’endomètre, de la vésicule biliaire, du foie et du pancréas (3, 4). En revanche, il a été rapporté un effet protecteur du DT2 pour le risque de cancer de la prostate : ce risque était diminué de 16 % chez les patients diabétiques dans une méta-analyse regroupant 19 études, mais cette association négative pourrait être liée à des niveaux de PSA plus faibles en cas de mauvais contrôle glycémique (5). Cette augmentation du risque de cancer ne concerne pas que le DT2, puisqu’une augmentation similaire a été rapportée chez les patients présentant un DT1 (4).
Une mortalité par cancer plus élevée
Chez les patients diabétiques, le risque de mortalité par cancer est majoré par rapport à la population générale d’environ 30 % (et plus spécifiquement de 20 à 80 % selon le siège de la tumeur). Alors que le cancer était jusqu’alors considéré, chez les patients diabétiques suédois, comme la deuxième cause de décès après les maladies cardiovasculaires, il apparaît désormais comme étant la première cause de mortalité, devant les maladies cardiovasculaires, chez les patients diabétiques au Royaume-Uni (6).
Absence de dépistage spécifique
En France, en fonction de la localisation du cancer, le dépistage est organisé (en population générale) ou ciblé (concernant une population spécifique, en fonction de facteurs de risque). Malgré le surrisque de cancer que présente la population diabétique, il n’y a pas de recommandation officielle de la part de l’Institut national du cancer (INCa) pour un dépistage spécifique au sein de cette population. De plus, dans certaines cohortes, les patients diabétiques présentent même parfois des taux de dépistage de cancers inférieurs à la population non diabétique. Malgré l’absence de recommandation officielle, une situation clinique fera rechercher attentivement une néoplasie chez un patient DT2 : la présence d’un amaigrissement important et involontaire (à en juger par la quantité d’activité physique et les choix alimentaires) et qui ne serait pas en adéquation avec l’importance du déséquilibre glycémique. En effet, chez le patient DT2, une perte de poids s’accompagne le plus souvent d’une amélioration de l’insulinorésistance et de l’équilibre glycémique. Une perte de poids associée à un déséquilibre glycémique rapide et important fera donc rechercher une pathologie intercurrente sous-jacente dont une néoplasie, et notamment pancréatique. À noter que pour le cancer pancréatique, le DT2 en lui-même semble être un de ses facteurs de risque, mais un diabète d’apparition récente peut également être l’une de ses manifestations précoces.
À retenir
• Diabète associé à un surrisque de cancer pour plusieurs localisations.
• Attention clinique particulière et vigilance accrue quant à la réalisation des examens de dépistage recommandé en population générale, chez les patients diabétiques.
• Vigilance face à tout déséquilibre glycémique brutal et inexpliqué chez un patient diabétique jusqu’alors équilibré.
Les mécanismes potentiels
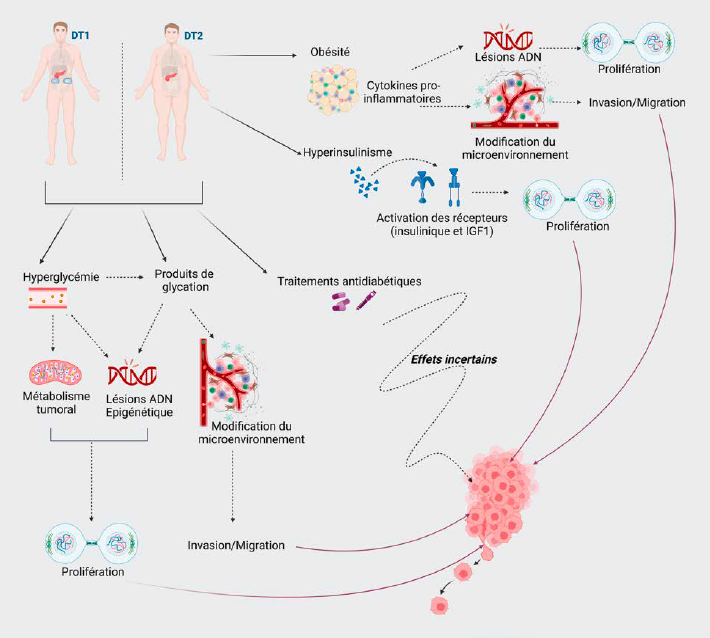
Les mécanismes spécifiques liés au diabète susceptibles de participer au développement du cancer sont encore incertains, mais de nombreuses hypothèses ont été établies (Fig. 1).
Figure 1 – Hypothèses multiples pouvant expliquer la relation diabète et cancer.
Hyperglycémie chronique et risque de cancer
La croissance tumorale implique la captation par la cellule tumorale de substrats énergétiques, dont le glucose, qui représente son principal nutriment. Cette consommation de glucose importante est d’ailleurs utilisée en imagerie oncologique (par exemple, en tomographie par émission de positons (TEP) avec traceur fluoro-2-déoxy-D-glucose marqué au fluor 18 (18F-FDG)). L’hyperglycémie chronique en elle-même pourrait favoriser le développement et la progression de lésions cancéreuses en induisant des dommages de l’ADN ou en modifiant la balance anti-oxydants/espèces réactives de l’oxygène (ROS). Des glycémies élevées peuvent également induire des modifications épigénétiques renforçant les caractéristiques cellulaires de croissance, même après le retour à des conditions normoglycémiques avec un phénomène de “mémoire hyperglycémique”.
Les études
Dans une étude suédoise, le diabète diagnostiqué avant 65 ans était associé à la survenue ultérieure de cancers du pharynx, de l’intestin grêle et du foie, et cette relation était dose-dépendante de la durée du diabète (7). Néanmoins, le rôle de l’hyperglycémie chronique dans le développement du cancer reste encore incertain. Par exemple, dans une étude française étudiant la survenue de cancer chez des patients DT2, les nouveaux cas de cancer ne survenaient pas chez des personnes ayant une durée de diabète plus longue, un taux d’HbA1C plus élevé, ou plus de complications vasculaires diabétiques (8). De plus, des méta-analyses suggèrent que l’amélioration du contrôle glycémique ne réduirait pas le risque de cancer. Dans des essais randomisés de contrôle glycémique comparant un traitement antidiabétique standard à un traitement intensif, une tendance à un nombre plus important de cas de cancers a été rapportée dans les bras des traitements standards versus intensifs : une méta-analyse mentionne 380 cas de cancer contre 357 dans les essais contrôlés randomisés incluant des patients atteints de DT2 (9), et 14 cas de cancer contre 7 sont retrouvés dans l’étude Diabetes control and complications trial (DCCT)/Epidemiology of diabetes interventions and complications (EDIC) pour le DT1 (10), mais ces différences n’étaient pas significatives.
Surpoids et risque de cancer
Le patient DT2 présente le plus souvent un surpoids ou une obésité. Or l’excès pondéral est associé dans de nombreuses études à un risque de cancer, mais également au risque de mortalité par cancer. Cette association pourrait s’expliquer par le rôle inflammatoire du tissu adipeux responsable de lésions de l’ADN et de modification du micro-environnement tumoral, favorisant le développement et la progression des cellules cancéreuses. De plus, il a été rapporté que la perte de poids pourrait, à l’inverse, réduire le risque de cancer associé à l’obésité. Cependant, l’obésité n’explique pas l’excès de cancers observé dans le DT1 et, dans une étude française, les patients DT2 qui développaient un cancer ne présentaient pas un IMC plus élevé que ceux qui n’en développaient pas (8).
Hyperinsulinisme et risque de cancer
Le patient DT2 présente initialement une phase d’hyperinsulinisme. Or l’insuline est un facteur de croissance cellulaire qui favorise la division cellulaire et inhibe l’apoptose. L’hyperinsulinisme pourrait ainsi contribuer au risque de développement et de progression de cancer, comme cela a été rapporté plus spécifiquement pour le cancer du sein, du poumon ou encore colorectal. Cependant, l’hyperinsulinisme n’explique pas l’excès de cancers observé dans le DT1.
Produits de glycation avancée et risque de cancer
Mécanismes
Les produits de glycation avancée, ou Advanced Glycation End-products (AGEs), constituent une base moléculaire importante de la mémoire métabolique. Produits par la glycation de protéines, lipides et acides nucléiques, ils s’accumulent au cours du vieillissement physiologique, mais leur production est accélérée en cas d’hyperglycémie chronique. Cette production est également plus ou moins rapide en fonction du mode de vie (quantité d’activité physique, choix alimentaires). Des études biologiques et cliniques suggèrent un rôle potentiel des AGEs sériques et tissulaires, et de l’interaction avec leurs récepteurs (RAGE), dans le développement de cancers de différentes localisations et dans le potentiel métastatique. Cette accumulation d’AGEs pourrait expliquer en partie l’effet des facteurs de risque de cancer liés au mode de vie, mais les données manquent dans le contexte spécifiquement diabétique. C’est pourquoi, une étude réalisée au CHU de Bordeaux (8) a recherché si l’autofluorescence cutanée (estimant l’accumulation cutanée des AGEs) pouvait prédire la survenue de cancer chez des patients DT2 qui n’avaient pas d’antécédent de cancer à l’inclusion. Les patients qui développaient un cancer au cours de leur suivi présentaient une autofluorescence cutanée à l’inclusion plus élevée que ceux qui n’en développaient pas, ce résultat fournissant un argument clinique supplémentaire en faveur du rôle des AGEs dans le développement de cancer chez les patients DT2.
En pratique
Diminuer les AGEs pourrait passer par la diminution des apports endogènes (par amélioration de l’équilibre glycémique, activité physique adaptée…), ou exogènes (par modification de l’alimentation, sevrage tabagique…). Une alimentation équilibrée et une activité physique modérée font d’ailleurs partie des recommandations thérapeutiques du DT2 (2). Il a été observé qu’une consommation élevée d’AGEs alimentaires était associée au risque de cancer et à un pronostic de cancer plus défavorable en population générale. Une réduction d’AGEs a été observée chez des patients diabétiques suivant un régime méditerranéen, et ce régime semble intéressant puisqu’une association entre ce type d’alimentation et une réduction du risque de cancer a été rapportée (11). Le régime méditerranéen se compose de légumes, de fruits, de céréales, de légumineuses, de noix, d’une consommation modérée de poissons et de produits laitiers, limitée en produits carnés et en alcool, avec une cuisson majoritairement effectuée à base d’huile d’olive. En ce qui concerne l’activité physique, il a été observé qu’une activité plus importante était associée à une accumulation d’AGEs plus faible dans un contexte diabétique, et qu’une activité physique d’intensité modérée à élevée était associée à une diminution du risque de cancer.
Traitements antidiabétiques et cancer
L’insuline
En 2009, quelques études observationnelles suggéraient une possible association entre l’insuline glargine et un risque de cancer. La création d’une insulinothérapie analogue passe par la modification de la structure de l’insulinothérapie humaine et pourrait ainsi modifier l’affinité de l’insuline à son récepteur, ce qui pourrait favoriser la croissance cellulaire. Cependant, en 2017, aucune preuve de surrisque de cancer, pour l’utilisation de l’insuline glargine ou de l’insuline détémir par rapport à l’insuline humaine, n’a été retrouvée au cours d’un suivi de plus de 5 ans dans l’étude CARING (CAncer Risk and INsulin analoGues) (12).
Les antidiabétiques oraux ou injectables
En ce qui concerne les antidiabétiques oraux ou injectables disponibles en France, le dernier consensus de ADA/ACS (American Diabetes Association/American Cancer Society) et le consensus de AACE/ACE (American Association of Clinical Endocrinologists/American College of Endocrinology) (13) mentionnaient que la somme des preuves impliquant ces médicaments dans le développement ou la progression néoplasique restait insuffisamment convaincante, et ces différentes associations ne retenaient pas d’effets tumoraux propres amenant à revoir leur usage en pratique clinique courante.
Les analogues du GLP-1
Plus spécifiquement, concernant les analogues du GLP-1, une prudence de prescription s’applique chez les patients ayant des antécédents pancréatiques, ainsi que des antécédents personnels ou familiaux de cancer médullaire de la thyroïde ou de NEM2. En effet, un doute existe quant au surrisque de cancers pancréatique et thyroïdien ; les différentes études ayant des résultats contradictoires. En France, l’ANSM (Agence nationale de sécurité du médicament et des produits de santé) a analysé en 2016 les données du SNIIRAM (Système national d’information inter-régimes de l’Assurance maladie) : les analogues du GLP-1 n’étaient pas associés au cancer du pancréas, sur un suivi de moins de 4 ans. Plus récemment, en 2022, une analyse cas-témoins a été réalisée à partir de données issues du SNDS (Système national des données de santé) et suggère que leur utilisation est associée à un risque accru de cancer de la thyroïde (14). La prudence demeure donc, et des études à long terme restent nécessaires.
La metformine
En revanche, il a été suggéré un effet protecteur de la metformine sur le risque de cancer à partir de données in vitro et épidémiologiques. Mais aucun essai clinique randomisé n’a encore confirmé cet effet.
À retenir
• Plusieurs facteurs potentiellement impliqués : hyperglycémie chronique en elle-même, surpoids et hyperinsulinisme, produits de glycation avancée.
• Pas d’effets tumoraux propres des traitements antidiabétiques actuellement retenus par les associations américaines de diabétologie, d’endocrinologie et d’oncologie.
• Corriger les facteurs de risque modifiables (diététique, activité physique, perte de poids…), communs aux deux pathologies.
Conclusion
Les patients diabétiques présentent un excès de risque de cancer et de mortalité par cancer. Malgré ce surrisque, il n’y a pas de recommandation spécifique de dépistage. Cependant, une vigilance accrue quant à la réalisation des examens de dépistage recommandé en population générale semble nécessaire chez les patients diabétiques.
Les mécanismes liés au diabète susceptibles de participer à la carcinogenèse (hyperglycémie en elle-même, AGEs, hyperinsulinisme, obésité…) et le lien entre cancer et thérapeutiques antidiabétiques restent incertains et nécessitent des études supplémentaires. Corriger les facteurs de risque environnementaux modifiables (diététique, activité physique, perte de poids…) est un point essentiel, d’autant plus qu’il s’agit de facteurs de risque communs au diabète et au cancer.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. International Diabetes Federation. IDF Diabetes Atlas 2021. 10th edition. 2021. Disponible sur : diabetesatlas.org/atlas/tenth-edition/.
2. American Diabetes Association Professional Practice Committee. Standards of medical care in diabetes – 2022. Diabetes Care 2021 ; 45 : Supplement 1.
3. Tsilidis KK, Kasimis JC, Lopez DS et al. Type 2 diabetes and cancer: umbrella review of meta-analyses of observational studies. BMJ 2015 ; 350 : g7607.
4. Harding JL, Shaw JE, Peeters A et al. Cancer risk among people with type 1 and type 2 diabetes: disentangling true associations, detection bias, and reverse causation. Diabetes Care 2015 ; 38 : 264-70.
5. Dankner R, Keinan Boker L, Boffetta P et al. A historical cohort study on glycemic-control and cancer-risk among patients with diabetes. Cancer Epidemiology. 2018 ; 57 : 104-9.
6. Pearson-Stuttard J, Bennett J, Cheng YJ et al. Trends in predominant causes of death in individuals with and without diabetes in England from 2001 to 2018: an epidemiological analysis of linked primary care records. Lancet Diabetes Endocrinol 2021 ; 9 : 165-73.
7. Bao C, Pedersen NL, Yang R et al. Diabetes in midlife and risk of cancer in late life: a nationwide swedish twin study: midlife diabetes and later life cancer risk in twins. Int J Cancer 2018 ; 143 : 793-800.
8. Foussard N, Larroumet A, Rigo M et al. Skin autofluorescence predicts cancer in subjects with type 2 diabetes. BMJ Open Diabetes Res Care 2021 ; 9 : e001312.
9. Johnson JA, Bowker SL. Intensive glycaemic control and cancer risk in type 2 diabetes: a meta-analysis of major trials. Diabetologia 2011 ; 54 : 25-31.
10. Orchard TJ, Nathan DM, Zinman B et al. Association between 7 years of intensive treatment of type 1 diabetes and long-term mortality. JAMA 2015 ; 313 : 45.
11. Schwingshackl L, Schwedhelm C, Galbete C et al. Adherence to mediterranean diet and risk of cancer: an updated systematic review and meta-analysis. Nutrients 2017 ; 9 : 1063.
12. But A, De Bruin ML, Bazelier MT et al. Cancer risk among insulin users: comparing analogues with human insulin in the CARING five-country cohort study. Diabetologia 2017 ; 60 : 1691-703.
13. Handelsman Y, Leroith D, Bloomgarden ZT et al. Diabetes and cancer–an AACE/ACE consensus statement. Endocr Pract 2013 ; 19 : 675-93.
14. Bezin J, Gouverneur A, Pénichon M et al. GLP-1 receptor agonists and the risk of thyroid cancer. Diabetes Care 2023 ; 46 : 384-90.