TOP 1 – Utilisation du système iLet Bionic Pancreas chez les enfants et les adultes vivant avec un diabète de type 1 : résultats d’une étude de vie réelle sur une durée de 2 ans
Depuis la publication initiale dans le New England Journal of Medicine en 2022 et sa validation par la FDA, le système iLet Bionic Pancreas a permis d’aider de nombreux sujets vivant avec un diabète de type 1 (DT1). Caractérisé par sa simplicité d’utilisation, ce système n’a besoin pour être activé que du poids du patient. Nul besoin de comptage de glucides aux repas, il suffit de préciser le type de repas (petit-déjeuner, déjeuner, dîner) et si la quantité est la même ou si elle est inférieure ou supérieure à la quantité habituelle.
L’étude de vie réelle
Dans une présentation passionnante réalisée par Steven J. Russel de la Harvard Medical School de Boston, les résultats d’une étude de vie réelle réalisée au cours des 2 premières années de commercialisation ont été détaillés.
Cette étude concernait des sujets adultes, mais également des enfants. Les principales caractéristiques du système iLet Bionic Pancreas sont représentées dans la figure 1 (avec les différents capteurs utilisables pour ce système de boucle fermée).
Figure 1 – Principales caractéristiques du système iLet Bionic Pancreas.
Les données des sujets utilisant ce système étaient accessibles sur un cloud spécifique (Beta Bionics cloud) et au total 14 369 sujets adultes et 2 025 enfants ont pu être étudiés en condition de vie réelle.
Résultats
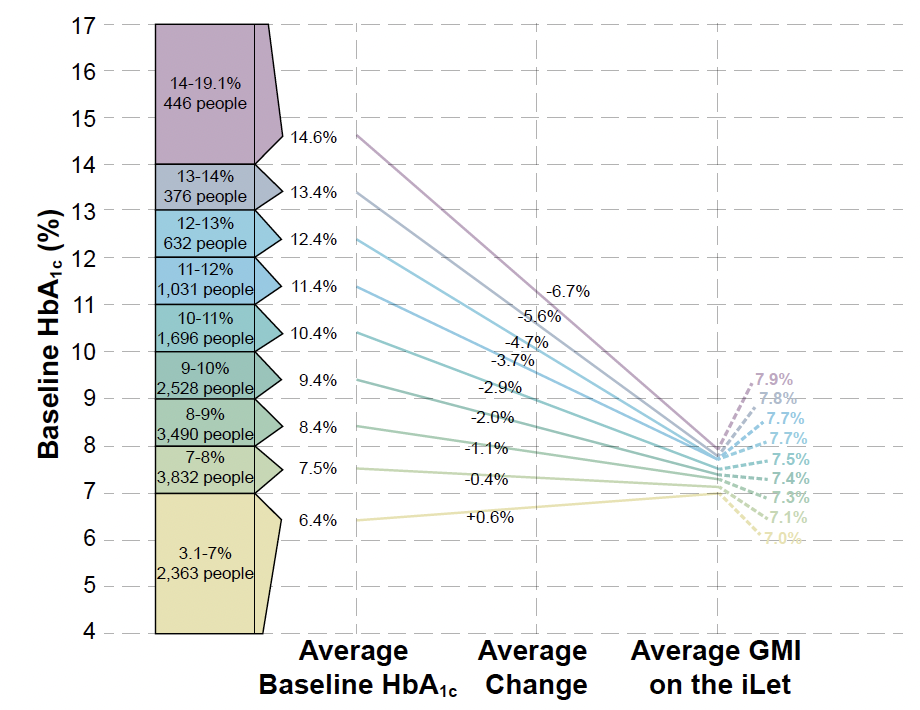
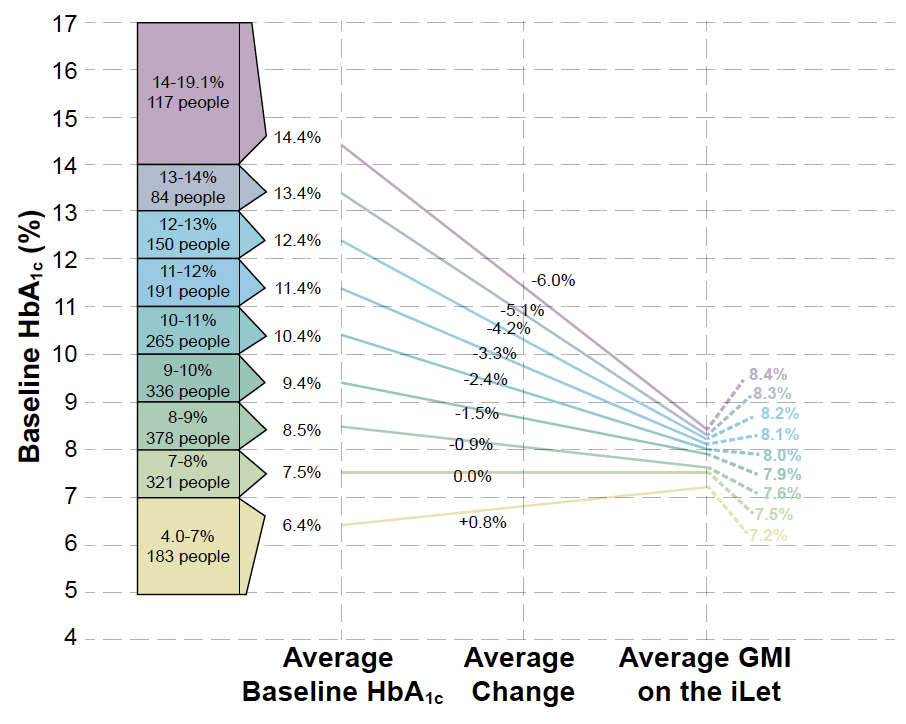
L’évolution de l’HbA1c initiale vers le GMI (indicateur de la gestion de la glycémie) estimé par le système iLet après 2 ans d’utilisation est reproduite dans la figure 2.
Figure 2 – Évolution de l’HbA1c vers le GMI estimé par iLet après 2 années d’utilisation dans la population globale (baseline HbA1c : 8,9 % ; iLet GMI : 7,3 % ; évolution : -1,6 %).
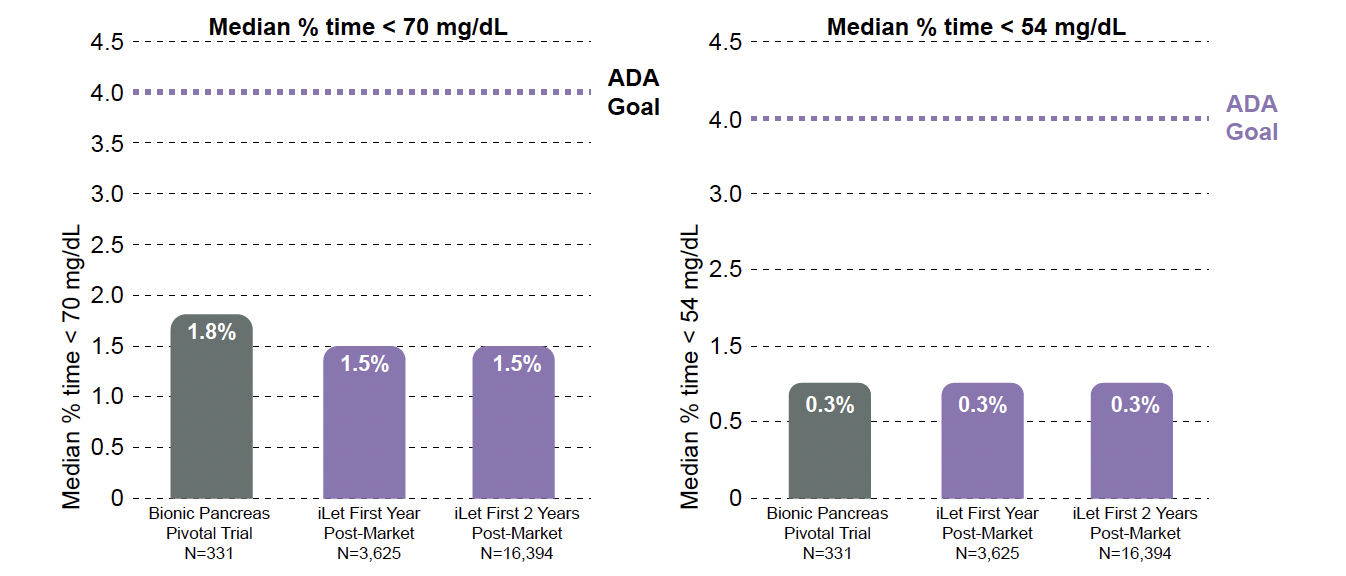
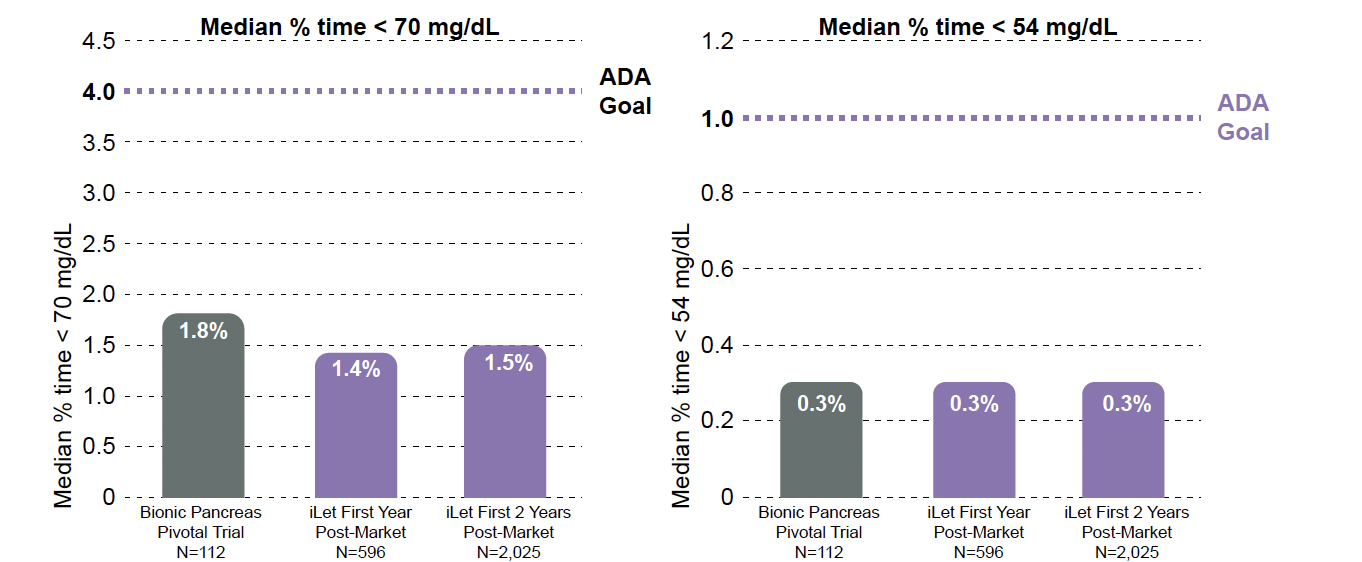
Pour l’ensemble de la population suivie, le temps passé en hypoglycémie avec iLet (< 70 mg/dl et
< 54 mg/dl) s’est avéré minime, comme représenté dans la figure 3.
Figure 3 – Temps passé en hypoglycémie de niveaux 1 et 2 dans la population globale.
Chez l’adulte
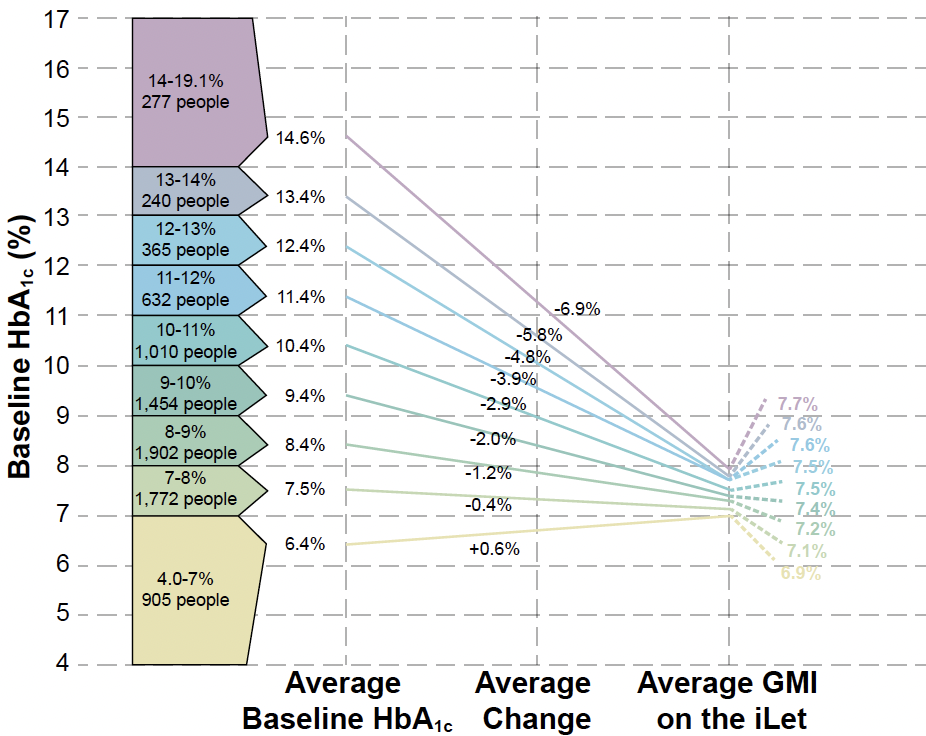
Ces résultats globaux ont été retrouvés spécifiquement chez les sujets adultes (Fig. 4 et 5).
Figure 4 – Évolution de l’HbA1c vers le GMI estimé par iLet dans la population adulte (baseline HbA1c : 9,1 % ; iLet GMI : 7,3 % ; évolution : -1,8 %).
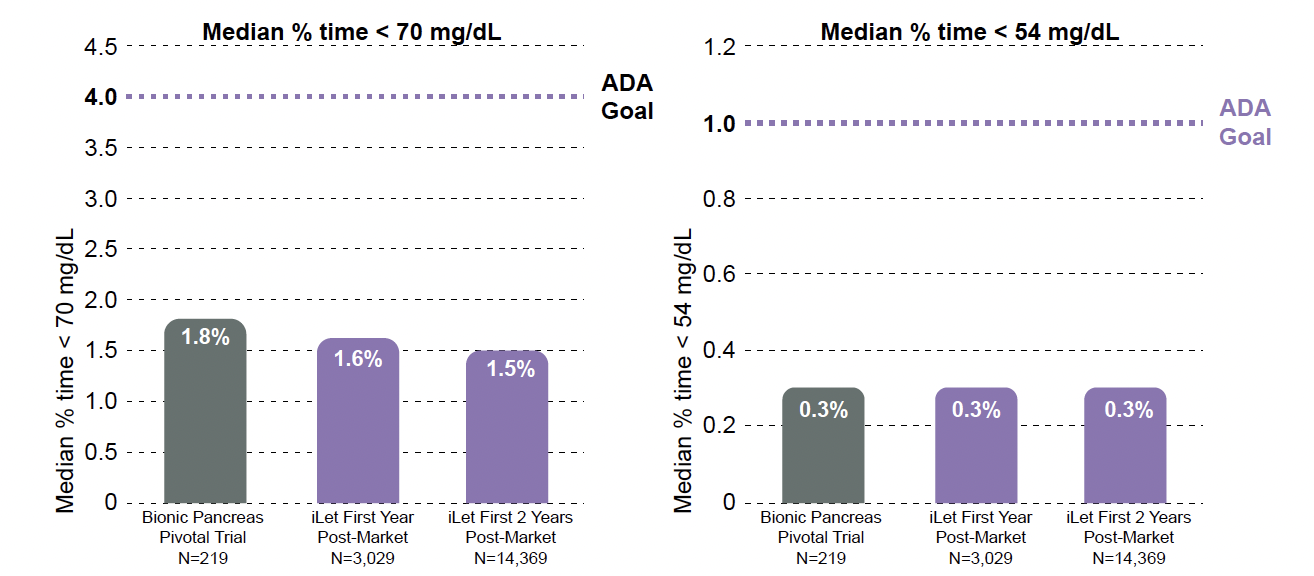
Figure 5 – Temps passé en hypoglycémie de niveaux 1 et 2 dans la population adulte.
Chez l’enfant
Concernant la population pédiatrique, généralement plus difficile à prendre en charge, l’évolution de l’HbA1c vers le GMI estimé par iLet s’est également montrée très satisfaisante (Fig. 6) et surtout le temps passé en hypoglycémie de niveaux 1 et 2 s’est révélé très adapté (Fig. 7).
Figure 6 – Évolution de l’HbA1c vers le GMI estimé par iLet dans la population pédiatrique (baseline HbA1c : 9,7 % ; iLet GMI : 7,8 % ; évolution : -1,9 %).
Figure 7 – Temps passé en hypoglycémie de niveaux 1 et 2 dans la population pédiatrique.
En pratique
L’ensemble de ces résultats confirme donc, en vie réelle, les résultats obtenus initialement aussi bien chez les adultes que dans la population pédiatrique. L’accord commercial signé récemment avec la société Abbott concernant l’utilisation de capteurs mixtes (glucose et corps cétoniques) devrait permettre de positionner le système iLet Bionic Pancreas comme l’un des acteurs majeurs du traitement du DT1 par boucle fermée dans les années à venir.
• Russel SJ, Selagamsetty R, Damiano E. Real-world efficacy of the iLet Bionic Pancreas in adults and children during the first eighteen months of commercial availability. Diabetes 2025 ; 74 : 129-OR.
TOP 2 – Utilisation du système Omnipod® 5 chez les sujets vivant avec un diabète de type 2 : résultats d’une étude américaine de vie réelle sur plus de 20 000 utilisateurs
Ce 85e congrès de l’ADA a, comme chaque année, tenu toutes ses promesses à Chicago, avec un foisonnement de résultats plus captivants les uns que les autres. La session scientifique consacrée à l’utilisation des boucles fermées n’a pas échappé à la règle, notamment chez les sujets vivant avec un diabète de type 2 (DT2).
L’étude
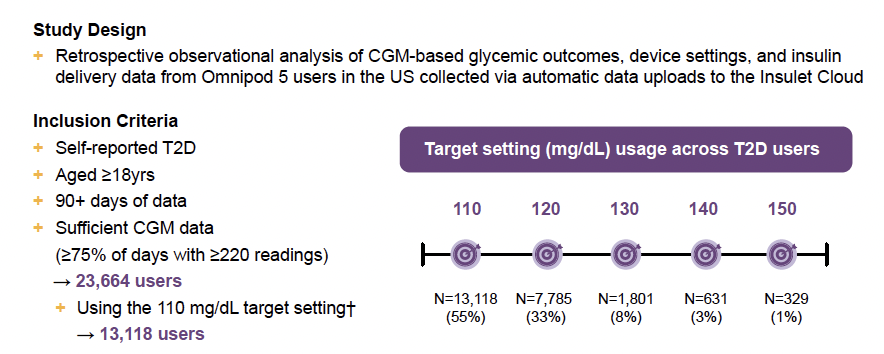
Au cours d’une présentation réalisée par Sean M. Oser de l’université du Colorado, les résultats d’une étude de vie réelle chez des sujets vivant avec un DT2 ont particulièrement attiré l’attention. Il s’agissait d’une étude rétrospective, dont le schéma et les caractéristiques des sujets inclus sont reproduits dans la figure 8.
Figure 8 – Schéma de l’étude et caractéristiques des sujets étudiés.
Résultats
Selon la cible glycémique
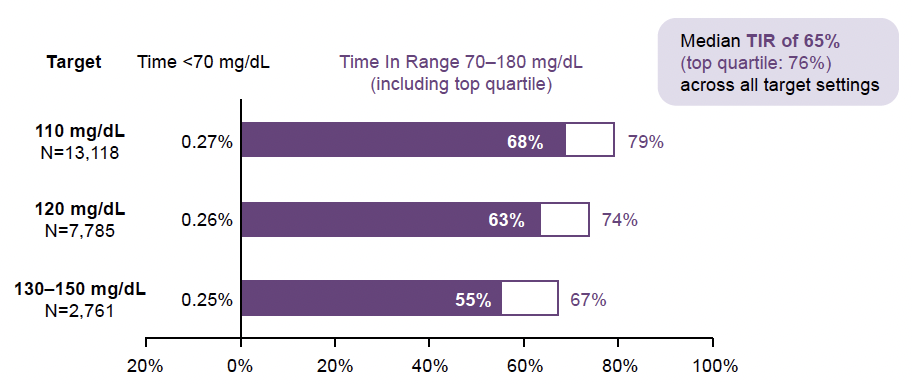
En fonction de la cible glycémique utilisée, le temps passé dans la cible (entre 70 et 180 mg/dl) et celui en dessous de la cible (< 70 mg/dl) se sont révélés différents avec un maximum de temps passé entre 70 et 180 mg/dl lorsque la cible était fixée à 110 mg/dl. Le temps passé en dessous de 70 mg/dl n’était pas augmenté de façon significative lorsque la cible glycémique de 110 mg/dl était utilisée (Fig. 9).
Figure 9 – Résultats obtenus en fonction de la cible glycémique retenue (23 664 sujets DT2).
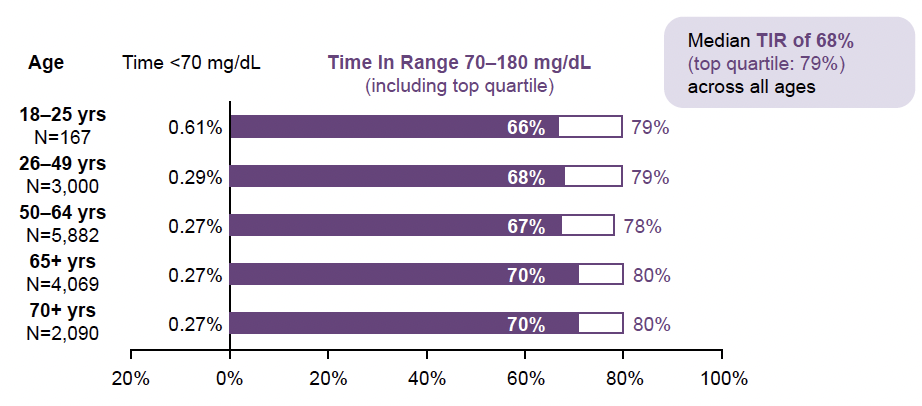
Selon l’âge
L’analyse des résultats obtenus en fonction de l’âge des sujets est reproduite dans la figure 10 et confirme l’homogénéité de l’efficacité du système Omnipod® 5 au cours du DT2 indépendamment de l’âge des sujets.
Figure 10 – Résultats obtenus en fonction de l’âge des sujets (13 118 sujets DT2 utilisant la cible la plus basse).
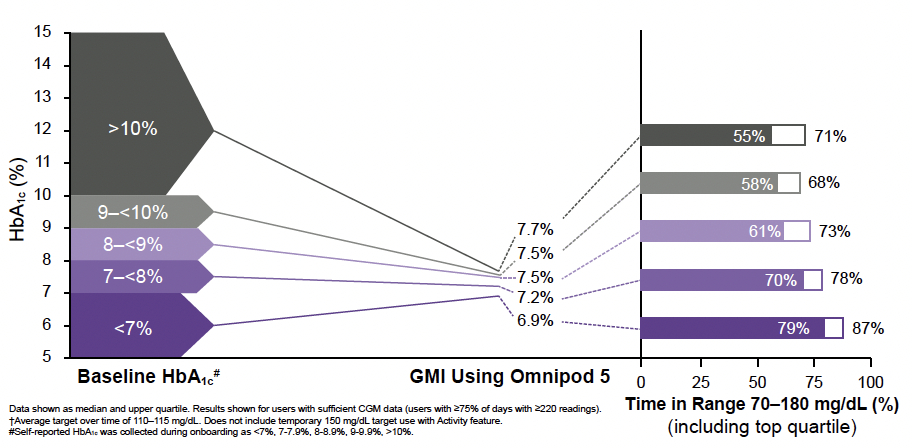
Selon l’HbA1c initiale
L’efficacité d’Omnipod® 5 a également été retrouvée indépendamment de la valeur initiale d’HbA1c, l’efficacité la plus spectaculaire étant retrouvée (comme c’est généralement le cas dans les études d’intervention en diabétologie) chez les sujets ayant initialement l’HbA1c la plus élevée (Fig. 11).
Figure 11 – Résultats obtenus en fonction de l’HbA1c initiale (4 795 sujets ayant rapporté leur HbA1c initiale et utilisant la cible la plus basse).
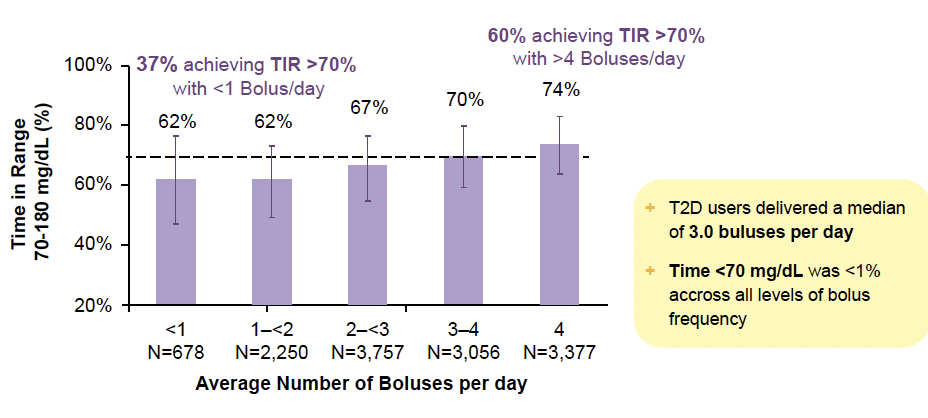
Selon la fréquence de bolus quotidienne
Les résultats obtenus ont été influencés par le nombre de bolus réalisés quotidiennement par les sujets étudiés et, là encore, sans surprise, l’efficacité du système Omnipod® 5 était d’autant plus grande que le nombre de bolus quotidiens était important (Fig. 12).
Figure 12 – Résultats obtenus en fonction du nombre de bolus quotidiens (13 118 sujets utilisant la cible la plus basse).
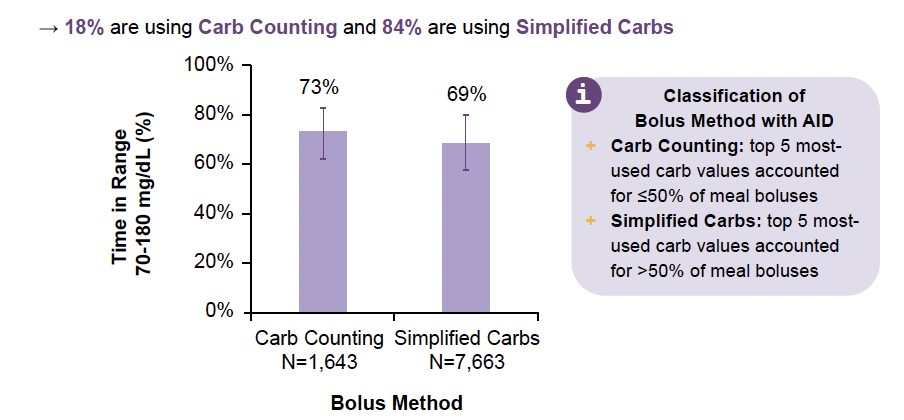
Selon les glucides alimentaires
Enfin, point important, l’évaluation des glucides alimentaires a également influencé les résultats, même si les résultats obtenus avec une évaluation approximative des glucides confirment l’efficacité du système Omnipod® 5 en l’absence d’évaluation optimale (Fig. 13).
Figure 13 – Résultats obtenus en fonction de la précision de l’évaluation glucidique (9 306 sujets DT2 utilisant la cible la plus basse avec au moins 30 jours de données de janvier à mars 2025).
En pratique
Les utilisateurs obtiennent un TIR élevé en utilisant le réglage cible le plus bas, avec très peu d’hypoglycémies. Le TIR médian est d’environ 80 % chez ceux ayant des réglages optimisés. La majorité des patients de cette étude utilise des méthodes simplifiées de bolus. Les résultats glycémiques sont excellents à tous les niveaux initiaux d’HbA1c, avec la plus grande amélioration estimée chez ceux ayant une HbA1c initiale plus élevée.
L’ensemble de ces résultats de vie réelle est donc en faveur de l’utilisation du système Omnipod® 5 chez les sujets vivant avec un DT2 lorsqu’une insulinothérapie optimisée est nécessaire.
• Oser SM, Peters AL, Pasquel FJ et al. Real-world glycemic outcomes in adults with type 2 diabetes (T2D) Using the Omnipod 5 automated insulin delivery (AID) system. Diabetes 2025 ; 74 : 130-OR.
TOP 3 – Utilisation d’une boucle fermée chez l’enfant de moins de 6 ans : résultats d’une étude de vie réelle sur une durée de 1 an avec le système t:slim X2 Control-IQ™
L’utilisation de la boucle fermée t:slim X2 Control-IQ™ a bien montré son intérêt chez les enfants entre 6 et 12 ans vivant avec un DT1 et la publication d’une étude multi-centrique française dans la revue Diabetes Care en 2024 a permis de confirmer l’efficacité et la sécurité d’utilisation de ce système dans cette tranche d’âge.
L’étude
Lors du dernier congrès de l’ADA à Chicago, une équipe italienne menée par Valentino Cherubini a présenté les résultats d’une étude de vie réelle menée pendant 1 an et comparant l’efficacité et la sécurité d’utilisation du système chez des enfants âgés de 6 mois à 5 ans à des enfants âgés de 6 à 10 ans. Certains réglages initiaux ont été proposés :
• l’algorithme Control-IQ™ nécessite un poids minimal saisi de 25 kg (55 lb) et une dose totale quotidienne d’insuline d’au moins 10 unités/jour ;
• pour tous les enfants pesant moins de 25 kg et/ou utilisant moins de 10 unités d’insuline par jour, les valeurs ont été standardisées en saisissant 25 kg pour le poids et 5 unités/jour d’insuline.
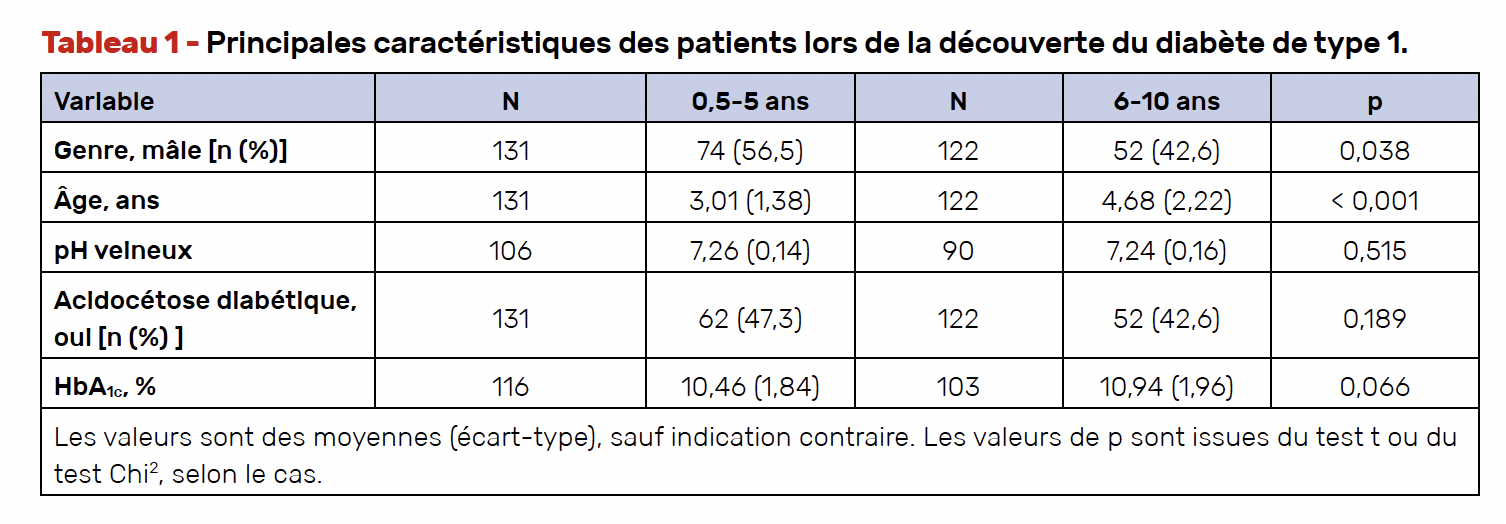
Au total, 32 centres hospitaliers italiens ont participé à cette étude, les paramètres cliniques, biologiques et les données de la MCG étant collectés tous les 6 mois, de l’initiation du système jusqu’à 18 mois d’utilisation. Les principales caractéristiques des patients lors de la découverte du DT1 sont décrites dans le tableau 1.
Résultats
Équilibre glycémique à l’initiation
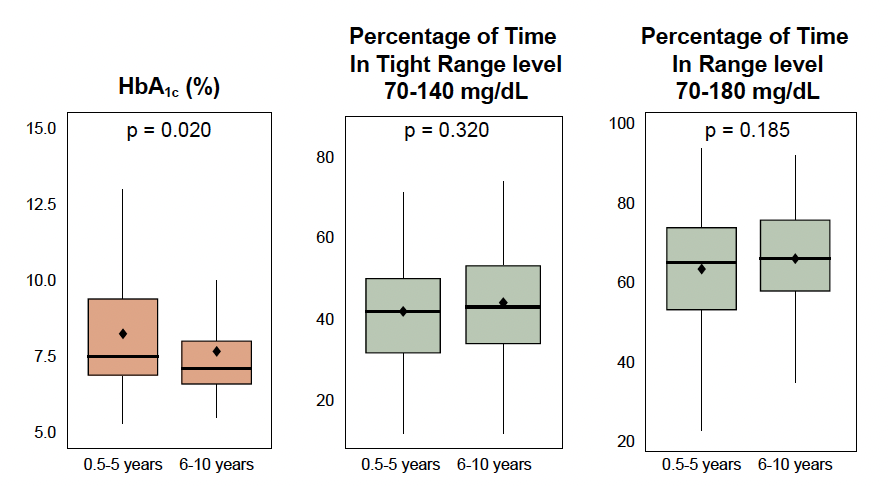
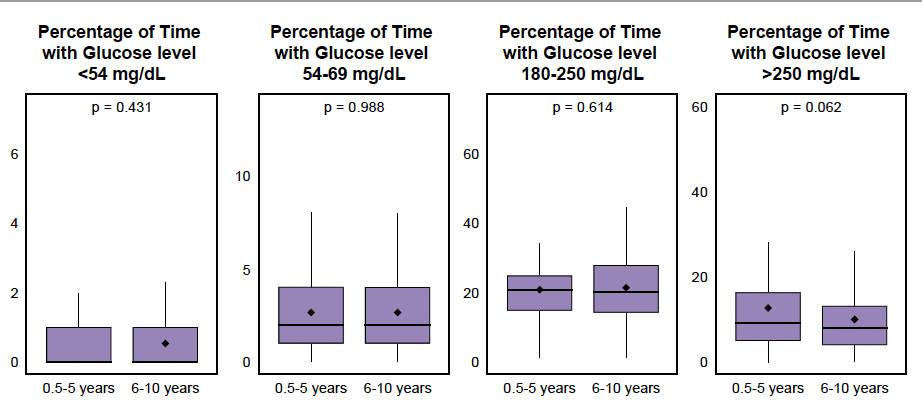
La qualité de l’équilibre glycémique lors de l’initiation du système t:slim X2 Control-IQ™ était différente entre les deux groupes avec une HbA1c plus élevée chez les patients âgés de 6 mois à 5 ans, le temps dans la cible étant un peu plus faible, mais de façon non significative (Fig. 14). Le temps passé en dessous de la cible et celui passé au-dessus de celle-ci n’étaient pas différents entre les deux groupes d’âge comme cela est représenté dans la figure 15.
Figure 14 – Paramètres généraux de l’équilibre glycémique à l’initiation du système t:slim X2 Control-IQTM.
Figure 15 – Temps passé en hypoglycémie de niveaux 1 et 2 et en hyperglycémie de niveaux 1 et 2 à l’initiation du système t:slim X2 Control-IQTM.
Évolution de l’équilibre glycémique au cours du temps
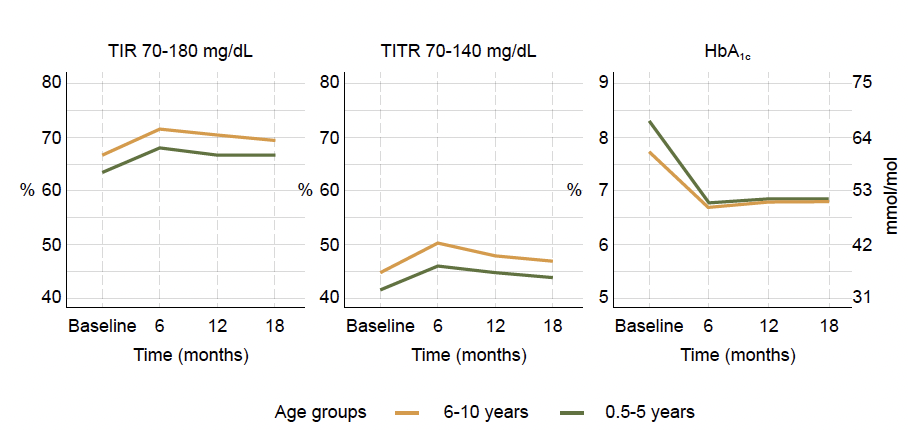
L’évolution grossièrement similaire des paramètres d’équilibre glycémique au cours du temps entre les deux groupes est reproduite dans la figure 16.
Figure 16 – Évolution du TIR, du TITR et de l’HbA1c au cours du temps dans les deux groupes d’âge.
Sécurité d’utilisation
Concernant la sécurité d’utilisation du système, un épisode d’acidocétose a eu lieu dans le groupe d’âge 6 mois à 5 ans après 12 mois d’utilisation et une hypoglycémie sévère dans le groupe 6 à 10 ans, là encore, après 12 mois d’utilisation du système. Après 18 mois d’utilisation de t:slim X2 Control-IQ™, le TBR < 54 mg/dl était de moins de
1 % dans les deux groupes.
En pratique
Ces résultats très rassurants ont permis aux auteurs de proposer les conclusions suivantes :
• Control-IQ™ a démontré des bénéfices similaires pour les enfants âgés de 6 mois à 5 ans par rapport à ceux âgés de 6 à 10 ans ;
• compte tenu des défis liés au contrôle glycémique chez les jeunes enfants, il est crucial d’adopter des systèmes technologiques avancés pour améliorer les résultats aux âges les plus jeunes.
• Cherubini V, Franceschi R, Marigliano M et al. Safety and effectiveness outcomes after one year with T:slim X2 Control-IQ technology in children with type 1 diabetes under six years. Diabetes 2025 ; 74 : 131-OR.
TOP 4 – Profil de la mesure continue du glucose sous-cutané dans le diabète de type 1 pré-clinique
Le dépistage du DT1 et l’exploration fine des stades pré-cliniques constituent actuellement une préoccupation importante des services de diabétologie aussi bien dans la population adulte que dans la population pédiatrique. Parmi les outils permettant d’évaluer la qualité de l’équilibre glycémique au cours de ces stades pré-cliniques, la mesure continue du glucose (MCG) se révèle particulièrement utile.
L’étude
Au cours du dernier congrès de l’ADA à Chicago, Brigitte I. Frohnert de l’université du Colorado a présenté l’évolution des profils de MCG de sujets ayant fait l’objet d’un dépistage du DT1 et chez qui la présence d’auto-anticorps dirigés contre les îlots de Langherans a été retrouvée (plus de 700 sujets au total). Chez ces sujets, une MCG a été proposée de façon intermittente tous les 3 à 6 mois.
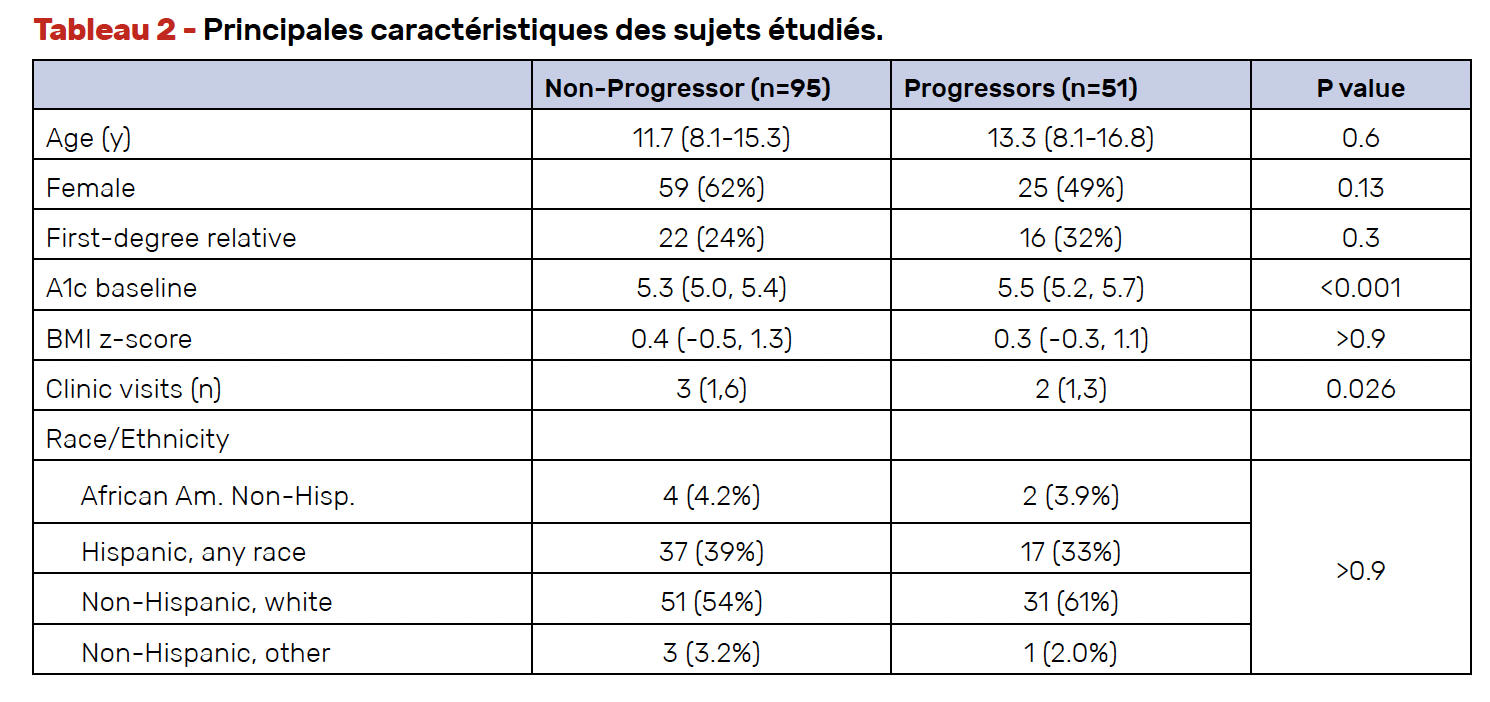
Les sujets arrivant au stade 3 (critères HGPO et HbA1c) ont été considérés comme “évolutifs” (n = 51), comparativement aux autres sujets “non évolutifs” (n = 95), avec au moins 1 an de suivi. Les principales caractéristiques de ces deux groupes de sujets sont présentées dans le tableau 2.
Résultats
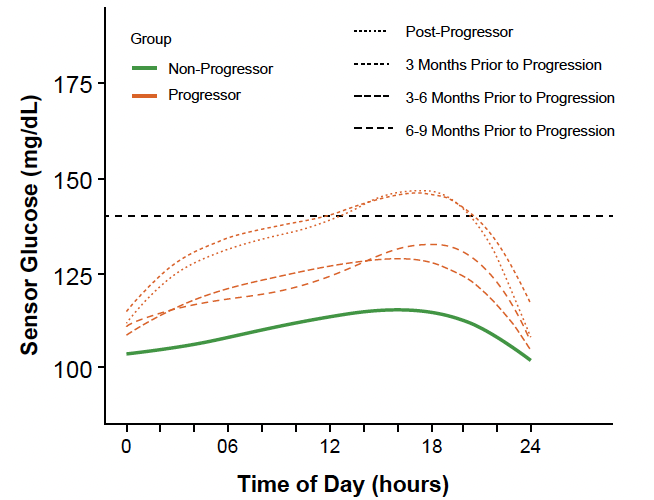
Le profil de la MCG des 24 heures à différents moments du suivi (6 à 9 mois avant apparition du stade 3, 3 à 6 mois et 3 mois avant apparition du stade 3, puis après apparition du stade 3) a permis de constater des différences significatives entre les sujets “évolutifs” et les sujets “non évolutifs” comme le montre la figure 17.
Figure 17 – Évolution comparative des profils de MCG en fonction du temps chez les sujets “évolutifs” et “non évolutifs”.
Selon les tranches horaires
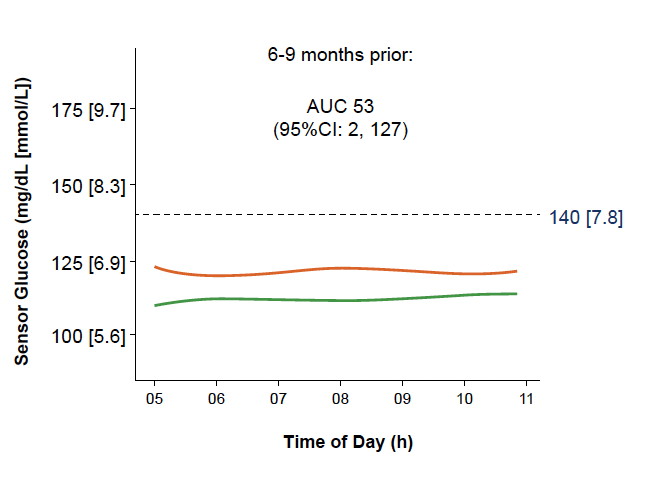
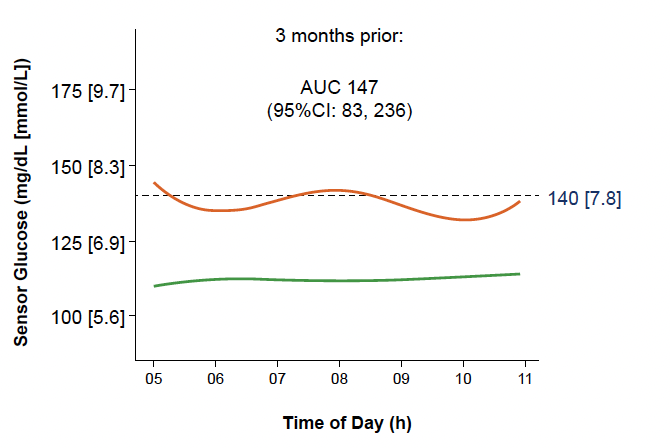
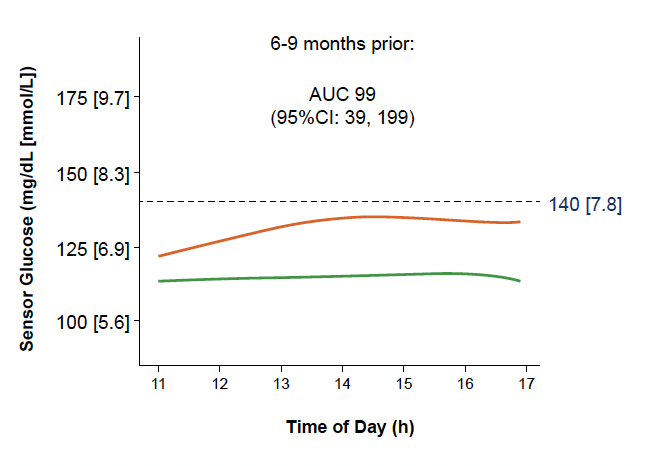
• L’analyse des données de MCG en fonction des tranches horaires et du délai avant passage au stade 3 chez les sujets “évolutifs” montre déjà des différences pour les données de 5 h à 11 h (Fig. 18). Ces différences sur les mêmes créneaux horaires se sont accentuées avec le temps (Fig. 19).
Figure 18 – Données de MCG entre 5 h et 11 h entre 6 et 9 mois avant passage au stade 3 chez les sujets “évolutifs” (courbe orange) comparées à celles des sujets “non évolutifs” (courbe verte).
Figure 19 – Données de MCG entre 5 h et 11 h 3 mois avant passage au stade 3 chez les sujets “évolutifs” (courbe orange) comparées à celles des sujets “non évolutifs” (courbe verte).
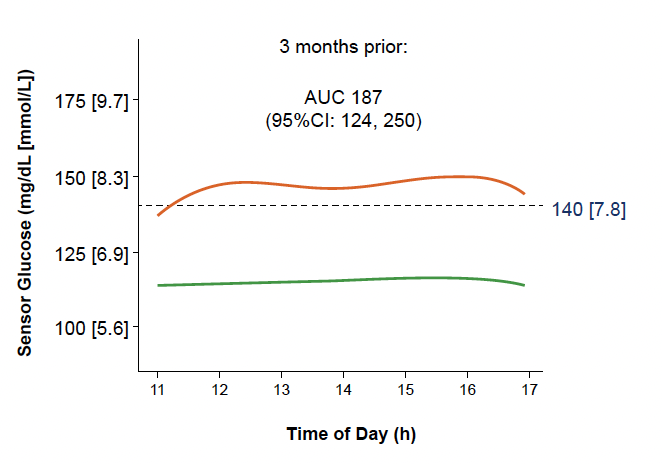
• De la même manière, des différences significatives ont pu être constatées pour les données de MCG entre 11 h et 17 h, entre 6 et 9 mois avant passage au stade 3 pour les sujets “évolutifs” comparativement aux sujets “ non évolutifs” (Fig. 20) et 3 mois avant (Fig. 21).
Figure 20 – Données de MCG entre 11 h et 17 h entre 6 et 9 mois avant passage au stade 3 chez les sujets “évolutifs” (courbe orange) comparées à celles des sujets “non évolutifs” (courbe verte).
Figure 21 – Données de MCG entre 11 h et 17 h 3 mois avant passage au stade 3 chez les sujets “évolutifs” (courbe orange) comparées à celles des sujets “non évolutifs” (courbe verte).
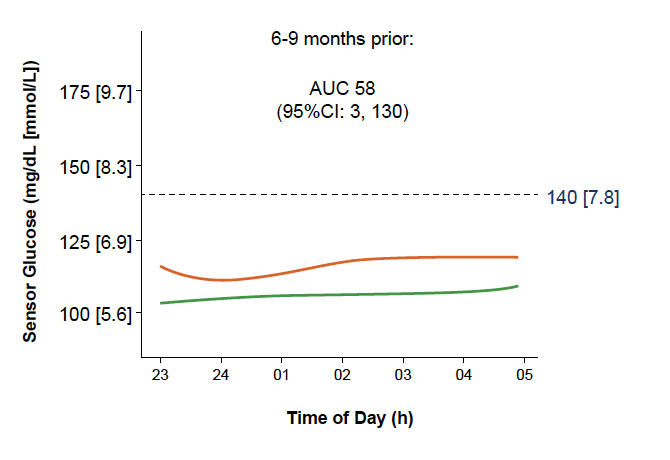
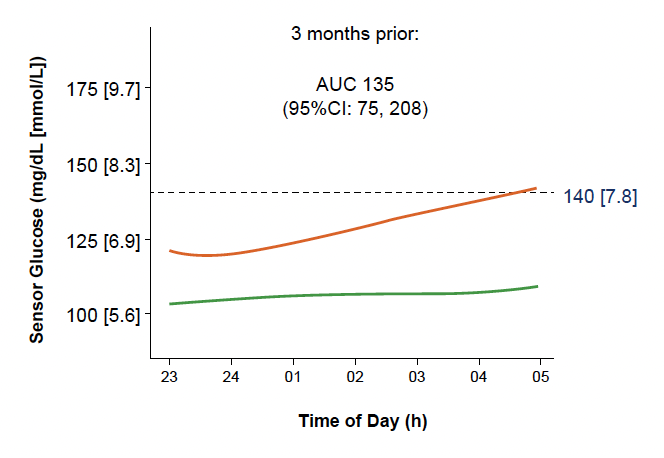
• Les différences étaient moins marquées entre les deux groupes pour les données de MCG entre 17 h et 23 h, alors qu’elles étaient plus nettes pour la période nocturne (Fig. 22 et 23).
Figure 22 – Données de MCG entre 23 h et 5 h entre 6 et 9 mois avant passage au stade 3 chez les sujets “évolutifs” (courbe orange) comparées à celles des sujets “non évolutifs” (courbe verte).
Figure 23 – Données de MCG entre 23 h et 5 h 3 mois avant passage au stade 3 chez les sujets “évolutifs” (courbe orange) comparées à celles des sujets “non évolutifs” (courbe verte).
En pratique
Ces données de MCG avant le passage au stade 3 du DT1 démontrent tout l’intérêt d’utiliser cet outil dans l’évaluation métabolique des sujets concernés. Les conclusions des auteurs vont dans ce sens :
• le profil quotidien de MCG évolue à l’approche du stade 3 ;
• les élévations l’après-midi apparaissent au moins 6 à 9 mois avant le stade 3 ;
• les valeurs nocturnes sont plus marquées dans les 3 mois précédant le stade 3.
Ils proposent notamment d’affiner davantage les mesures MCG, en fonction des créneaux horaires, pour prédire le moment de transition vers le stade 3 du DT1.
• Frohnert BI, Vigers TB, Dong F et al. Evolution of CGM Patterns prior to Stage 3 T1D. Diabetes 2025 ; 74 : 168-OR.
TOP 5 – Accompagnement diététique personnalisé sur les résultats de la mesure continue du glucose chez des patients présentant un diabète de type 2 de découverte récente : résultats d’une étude chinoise
Si l’utilisation de la MCG a révolutionné la prise en charge thérapeutique des sujets vivant avec un diabète insulino-traité, son utilisation chez des sujets non insulinotraités, voire chez des sujets sans traitement anti-hyperglycémiant, suscite encore beaucoup de travaux et d’interrogations. Les modifications comportementales potentiellement induites par l’utilisation de la MCG pourraient modifier radicalement le parcours de soins au cours du DT2, en particulier à un stade précoce d’évolution.
L’étude
Lors du dernier congrès de l’ADA, une équipe chinoise représentée par le Dr Heng Wan de l’université de Shanghai a présenté les résultats d’une étude clinique centrée sur l’utilisation de la MCG à un stade précoce du DT2.
Il s’agissait d’une étude randomisée contrôlée, en groupes parallèles, ouverte, sur 3 mois. Les patients, nouvellement diagnostiqués, étaient randomisés en deux groupes :
• groupe témoin : éducation nutritionnelle standard ;
• groupe d’intervention : éducation nutritionnelle standard + dispositif CGM et retour personnalisé ;
et suivis jusqu’à la consultation de suivi en ambulatoire à 3 mois.
Les critères d’inclusion et d’exclusion sont synthétisés dans le tableau 3. Les caractéristiques des patients à l’inclusion étaient comparables dans les deux groupes.
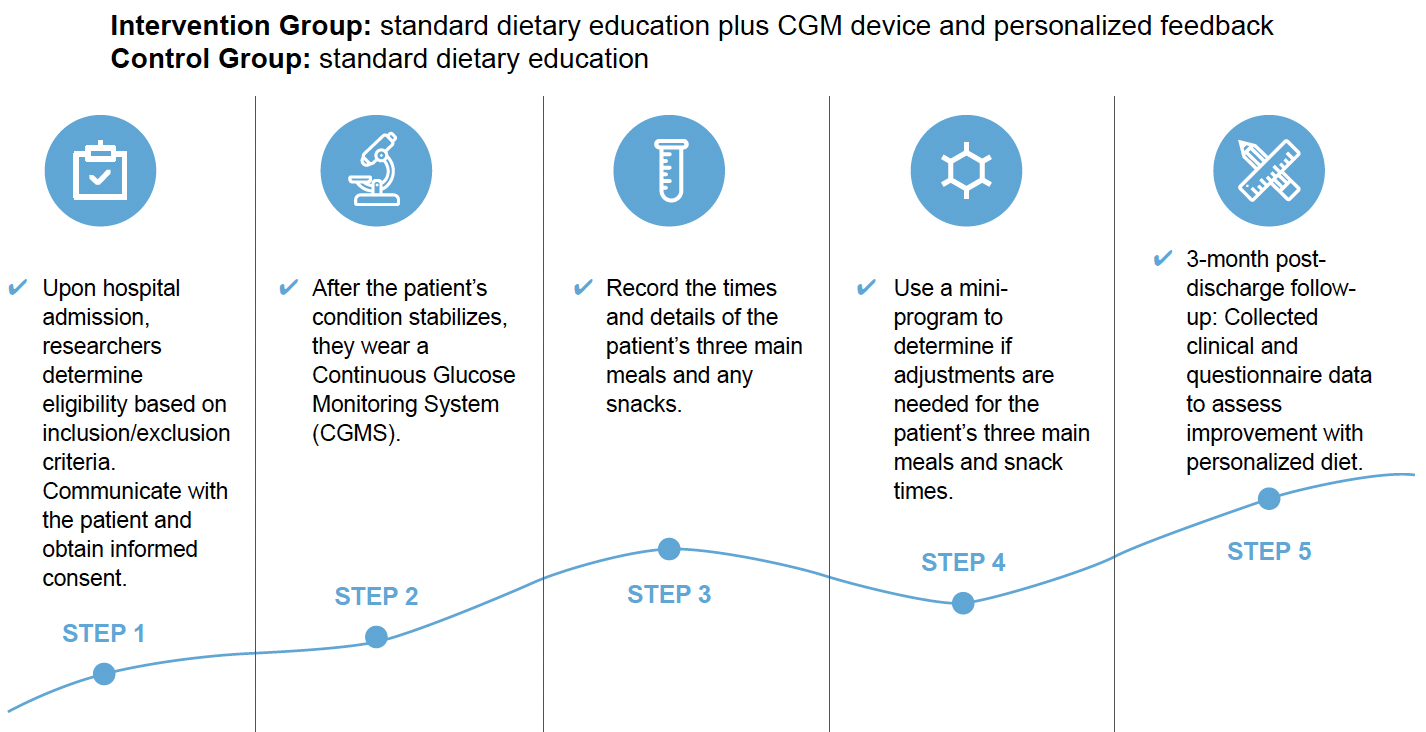
Les différentes étapes de cette étude clinique sont reproduites dans la figure 24.
Figure 24 – Étapes de l’étude clinique concernant l’utilisation de la MCG au stade initial du diabète de type 2.
Une application spécifique a permis d’enregistrer les détails des prises alimentaires ainsi que les horaires des prises alimentaires lors du port de la MCG et un matching a pu être réalisé avec les données de la MCG, permettant au patient et au soignant de modifier de façon individualisée les consignes alimentaires en fonction des habitudes du patient et des résultats de la MCG.
Résultats
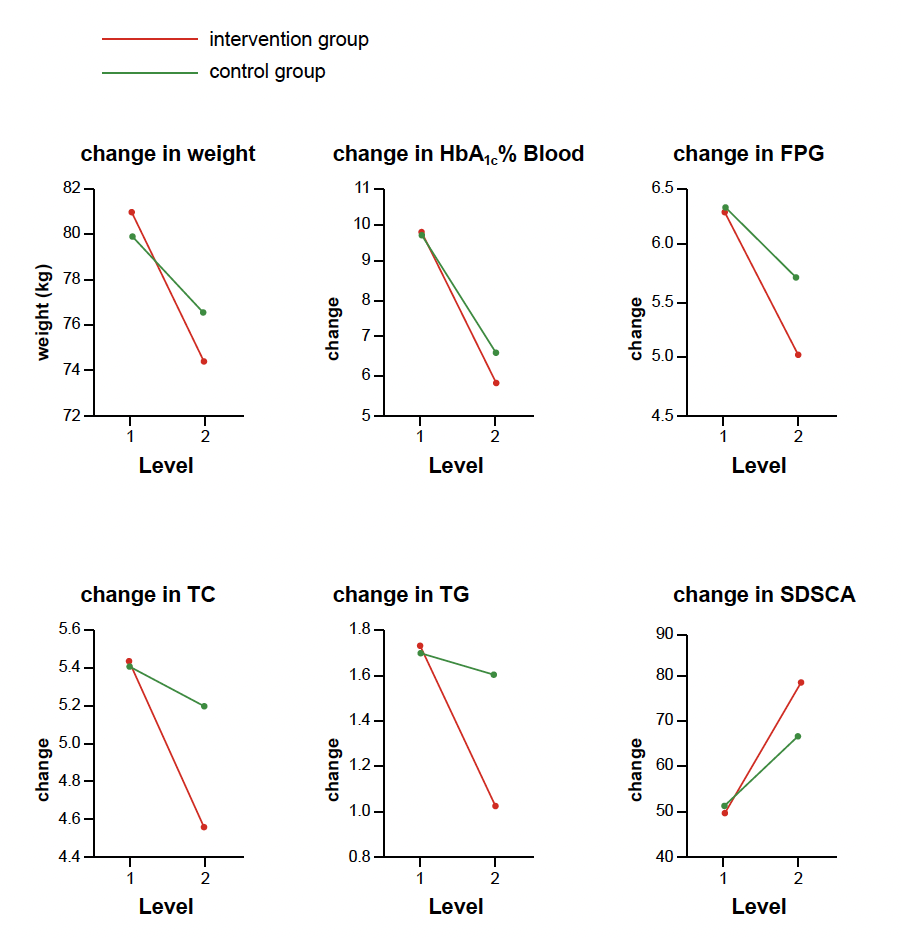
L’évolution à 3 mois a permis de montrer une amélioration significative d’un certain nombre de paramètres cliniques et biologiques dans le groupe ayant bénéficié de l’utilisation de la MCG (Fig. 25). On observe notamment une amélioration du poids, de l’HbA1c, du taux de lipides (TC/TG) ainsi que de meilleurs scores d’auto-gestion.
Figure 25 – Représentation graphique de l’évolution à 3 mois de différents paramètres.
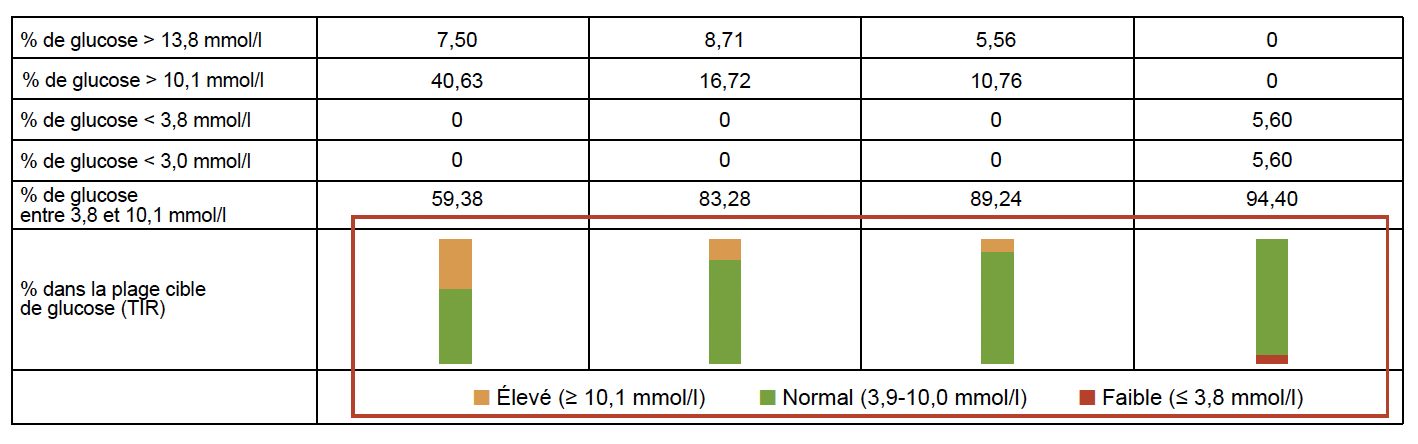
L’analyse des données de MCG a permis d’objectiver une amélioration spectaculaire des différents paramètres, avec en particulier une augmentation importante du TIR entre 70 et 180 mg/dl (Fig. 26).
Figure 26 – Évolution du TIR à 3 mois chez les sujets utilisant la MCG.
En pratique
Les auteurs concluent qu’une orientation diététique personnalisée via une plateforme numérique améliore l’HbA1c, la glycémie et l’auto-gestion chez les personnes récemment diagnostiquées DT2.
Cette étude présente toutefois plusieurs limites méthodologiques, notamment, comme le pointent les auteurs :
• un suivi seulement de 3 mois qui pourrait avoir sous-estimé les effets à long terme ;
• le système d’enregistrement pourrait poser des problèmes d’utilisation pour les personnes âgées.
Même si elle ne permet pas de tirer des conclusions définitives, elle ouvre la voie à des essais de plus grande envergure destinés de déterminer avec plus d’objectivité la place de la MCG au cours de l’évolution du diabète de type 2.
Pour les auteurs, elle montre le potentiel de l’éducation numérique dans la gestion du diabète ainsi que l’importance des approches personnalisées pour améliorer les résultats cliniques de patients. De plus, cela élargit les possibilités d’utilisation de la MCG à des fins éducatives.
• Wan H, Yao N, Gui Z et al. The effectiveness of personalized dietary advice based on CGM data for newly diagnosed patients with type 2 diabetes. Diabetes 2025 ; 74 : 6-OR.
L’auteur déclare avoir des liens d’intérêt avec Abbott, Dexcom, Tandem.