TOP 1 – Le diabète gestationnel précoce
Une conférence a été donnée au sujet du diabète gestationnel précoce : Norbert Freinkel Award Lecture – Gestational diabetes – Early risk factors, treatment, and the path to prevention.
L’étude TOBOGM (1)
Dans cette étude multicentrique internationale, des femmes enceintes avec un facteur de risque de diabète gestationnel ont réalisé une HGPO 75 g entre la 4 et la 19e semaines de grossesse, qui a conduit au diagnostic de diabète gestationnel précoce chez 802 d’entre elles selon les critères classiques (0,92-1,80-1,53). Elles ont ensuite été randomisées :
• soit pour bénéficier immédiatement du traitement du diabète gestationnel,
• soit pour réaliser une nouvelle HGPO entre 24 et 28 semaines et initier le traitement du diabète gestationnel si nécessaire à partir de ce moment-là.
Le critère principal de jugement néonatal était un composite. Les critères supplémentaires de jugement étaient l’hypertension artérielle gravidique et la masse maigre fœtale.
Résultats
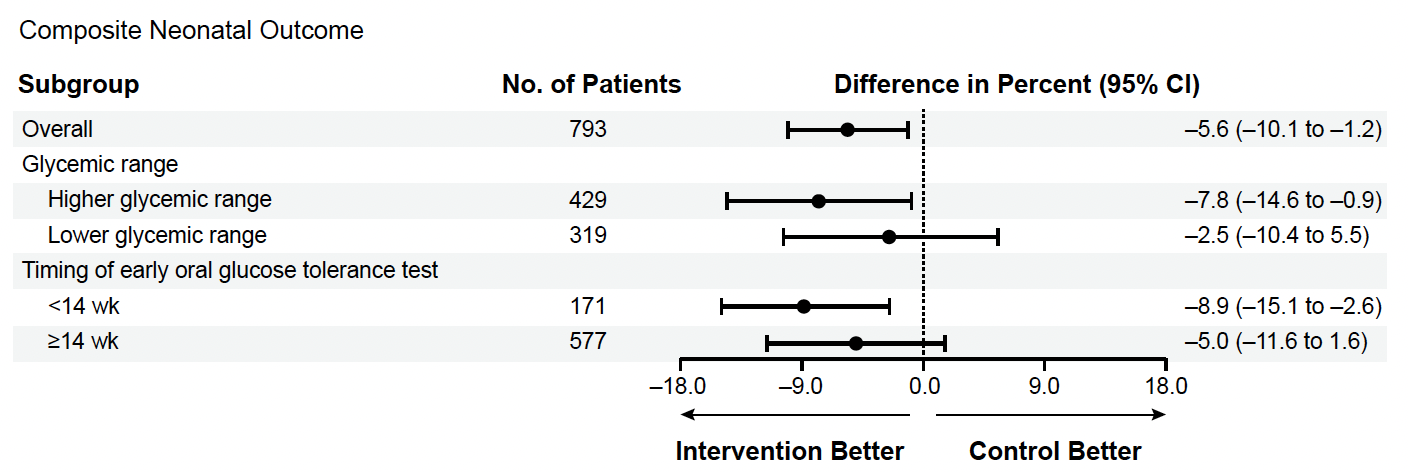
Le critère principal de jugement était réduit chez les femmes au traitement précoce (odd-ratio ajusté 0,82 (IC 95 % = 0,68-0,98). Il faut traiter 18 femmes pour éviter un de ces événements. Cependant, cette différence significative n’est trouvée que pour le critère composite et pour aucun des facteurs composant ce critère pris de façon isolée. L’effet favorable était d’autant plus marqué que le niveau des glycémies était plus élevé à l’inclusion (séparé en deux groupes) et que l’HGPO initiale était réalisée avant 14 semaines. Aucun des autres critères de jugement n’était différent entre les deux groupes (Fig. 1).
Figure 1 – TOBOGM : principaux résultats.
Pour mémoire, 33 % des patientes dont l’HGPO était pathologique en début de grossesse ont vu celle-ci se normaliser entre 24 et 28 semaines, ce qui pose la question de diagnostic (par excès ?) du diabète gestationnel quand le test est réalisé précocement.
Les études ancillaires de TOBOGM
Depuis cette publication, des études ancillaires ont montré différents aspects (dans PubMed, TOBOGM donne 21 références).
• Les modalités de diagnostic diffèrent selon les origines ethniques des personnes, les femmes asiatiques ayant plus volontiers des glycémies post-prandiales élevées ; la prévalence du diabète gestationnel précoce est également plus élevée chez les femmes asiatiques avec un risque relatif de 2,28 à 2,43 par rapport aux femmes caucasiennes (2).
• Les femmes étaient invitées à refaire une HGPO 6 à 12 semaines après la naissance (3). Seulement 44 % d’entre elles l’ont réalisée et 26 % de celles-ci présentaient une dysglycémie. L’analyse multivariée montre que les facteurs prédictifs indépendants d’une dysglycémie après la naissance sont un antécédent de diabète gestationnel, une prise de poids plus importante pendant la grossesse et des valeurs plus élevées à 1 h ou 2 h de l’HGPO initiale.
• Beaucoup de femmes ont été screenées pour le recrutement dans l’étude (4). Le critère composite était plus fréquent chez les femmes avec une anomalie précoce de l’HGPO (mais qui n’ont pas été traitées) que chez celles chez qui le diagnostic a été fait après 24 semaines ou chez les femmes à la glycémie normale tout au long de la grossesse, avec un risque relatif du critère composite de 1,59 (IC 95 % = 1,18-2,12).
L’étude LEMA GDM
Un essai multicentrique français, LEMA GDM, est en cours pour évaluer l’effet d’une prise en charge immédiate ou différée d’un diabète gestationnel précoce, dépisté cette fois sur la glycémie à jeun au premier trimestre.
L’étude STEADY SUGAR
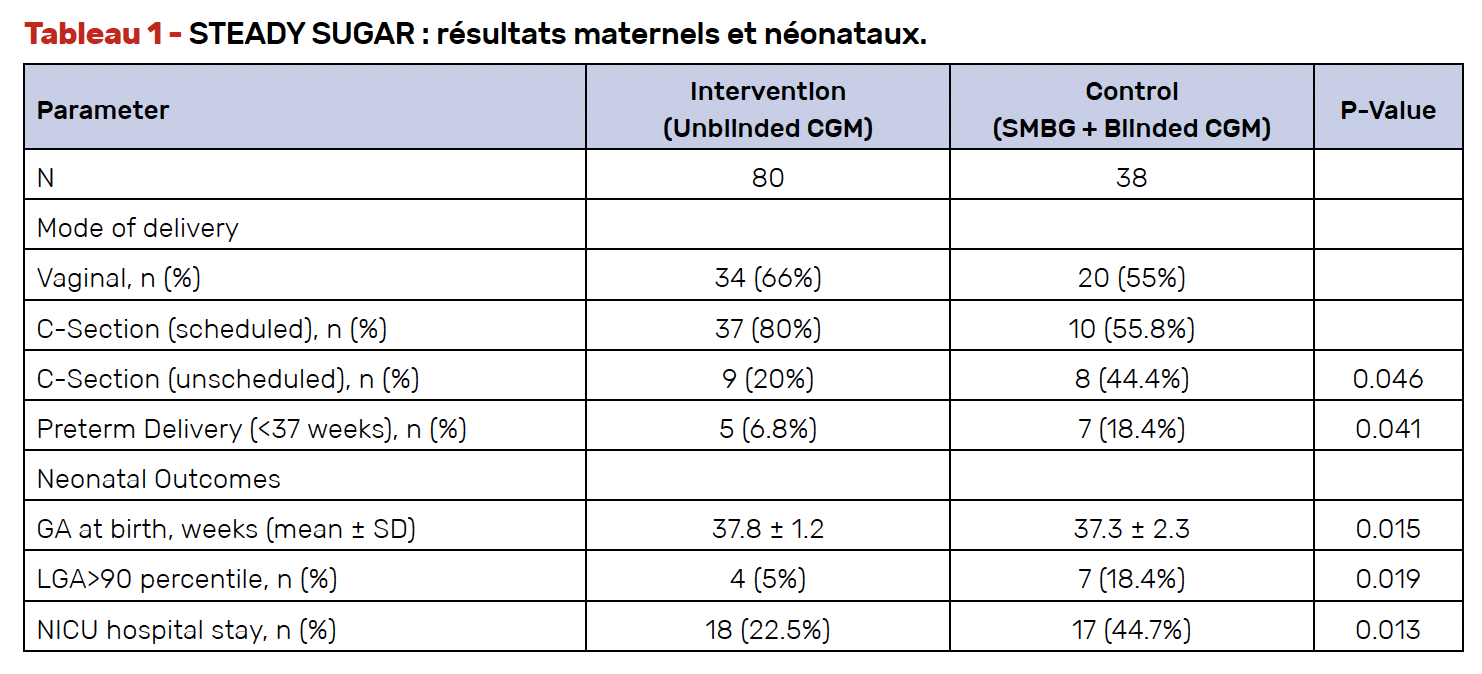
L’étude STEADY SUGAR (5) s’est intéressée à l’utilisation du CGM dans le diabète gestationnel précoce. Après diagnostic par HGPO (entre 8 et 26 semaines), les femmes étaient randomisées entre le port d’un CGM versus des glycémies capillaires (avec un CGM en aveugle), le reste de la prise en charge étant similaire.
Résultats
Malgré un effectif modeste (au total 120 personnes), cette étude montre qu’un plus grand nombre de femmes dans le groupe CGM parvient à l’objectif de temps dans la cible, et que les issues de grossesses et la santé du nouveau-né sont améliorées par le port du CGM (Tab. 1).
1. Simmons D, Immanuel J, Hague WM et al. Treatment of gestational diabetes mellitus diagnosed early in pregnancy. N Engl J Med 2023 ; 388 : 2132-44.
2. Yuen L, Wong V, Immanuel J et al. Ethnic differences in characteristics of women diagnosed with early gestational diabetes: findings from the TOBOGM study. J Clin Endocrinol Metab 2025 ; 110 : e2471-e2484.
3. Cheung NW, Rhou YJJ, Immanuel J et al. Postpartum dysglycaemia after early gestational diabetes: Follow-up of women in the TOBOGM randomised controlled trial. Diabetes Res Clin Pract 2024 : 218 : 111929.
4. Simmons D, Immanuel J, Hague WM et al. Perinatal outcomes in early and late gestational diabetes mellitus after treatment from 24-28 weeks’ gestation: a TOBOGM secondary analysis. Diabetes Care 2024 ; 47 : 2093-101.
5. Elkind-Hirsch KE, Armata ML, Veillon EW et al. CGM in early gestational diabetes improves maternal glycemic control and neonatal outcomes—The Steady Sugar trial. Diabetes 2025 ; 74 : 180-OR.
TOP 2 – Insuline hebdomadaire : les résultats de QWINT
L’étude QWINT-1 (6)
L’objectif de cette étude de phase III est de montrer la non-infériorité de l’insuline efsitora versus l’insuline glargine sur l’HbA1c chez des personnes vivant avec un diabète de type 2 (DT2) naïfs de traitement par insuline. Elle utilise un algorithme simple de titration des doses avec un stylo à dose fixe. L’objectif sous-jacent est de simplifier cette initiation de traitement.
Il s’agit d’une étude randomisée de 52 semaines de traitement pour 795 personnes, 50 % de femmes. L’ajustement des doses était hebdomadaire avec le même objectif glycémique dans les deux groupes.
Résultats
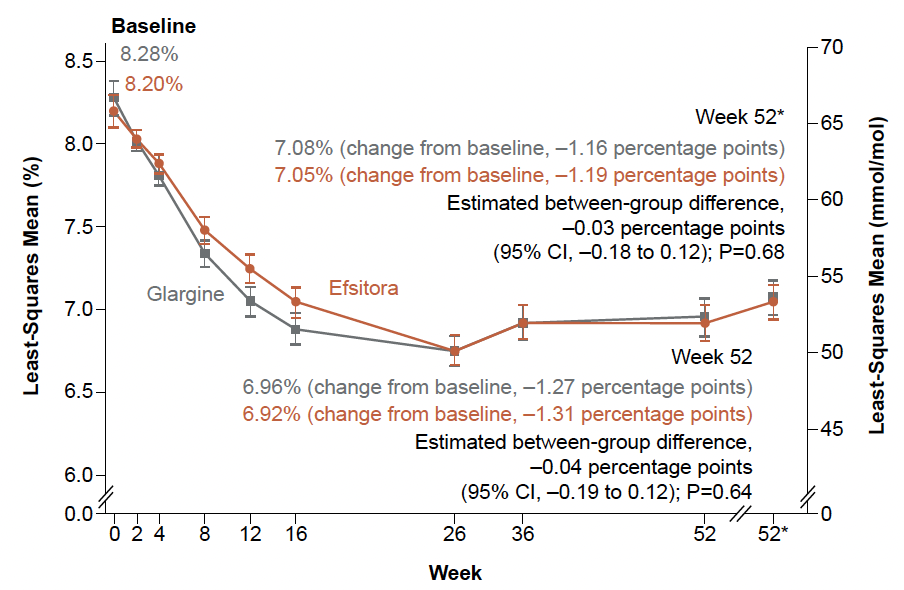
L’HbA1c évolue de façon similaire dans les deux groupes, et efsitora n’est pas inférieure (ou supérieure) à glargine (Fig. 2). Le nombre d’épisodes d’hypoglycémies (cliniquement significatives, niveau 2, et sévères, niveau 3) est 43 % inférieur dans le bras efsitora.
Figure 2 – QWINT-1 : comparaison de l’HbA1c entre insuline efsitora (rouge) et glargine (noir).
L’étude QWINT-3 (7)
Une étude similaire, concernant 986 personnes vivant avec un DT2 déjà sous traitement par insuline basale (QWINT-3) avec les mêmes design et objectif, mais sur une durée de 78 semaines, compare l’insuline efsitora à l’insuline dégludec avec un ratio 2:1. Le switch vers efsitora s’est fait en multipliant la dose quotidienne par sept (à 10 unités près) et la dose habituelle a été choisie pour le switch dégludec. L’adaptation de dose était ensuite hebdomadaire.
Résultats
De la même façon, le critère principal de non-infériorité à 26 semaines a été satisfait sur HbA1c. Le changement d’HbA1c est plus important à 52 semaines sous efsitora, mais n’est plus différent à
78 semaines. Les hypoglycémies de niveaux 2 (< 54 mg/dl) et 3 (sévères) avaient la même fréquence dans les deux groupes. Les hypoglycémies de niveau 1 (55-70 mg/dl) étaient plus fréquentes dans le bras efsitora pendant toute l’étude.
L’étude QWINT-4 (8)
L’étude QWINT-4 compare l’insuline efsitora à l’insuline glargine chez 730 personnes vivant avec un DT2 déjà sous traitement par insuline basale-bolus (au moins deux préprandiales) et pendant 26 semaines. Les personnes pouvaient continuer les traitements oraux et les agonistes du récepteur au GLP-1 (aGLP-1). Les bolus ont été réalisés avec insuline lispro.
Résultats
La diminution de l’HbA1c à 26 semaines est similaire dans les deux groupes, indiquant la non-infériorité d’efsitora par rapport à glargine (de 8,2 à 7,2 %). Les données de CGM ne diffèrent pas entre les groupes (TIR : 61 % efsitora, 59 % glargine ; TBR 55-70 : 1,2 % efsitora, 1,1 % glargine ; TBR < 54 : 0,4 % efsitora, 0,4 % glargine). De même que dans les autres études QWINT, les hypoglycémies de niveau 2 ou 3 n’étaient pas différentes dans les deux groupes.
En pratique
Au total, et dans l’objectif de simplifier le traitement des personnes vivant avec un DT2, n’atteignant pas les cibles de HbA1c, les études QWINT suggèrent qu’une injection hebdomadaire d’efsitora améliore l’HbA1c de façon équivalente à la glargine, sans provoquer plus d’hypoglycémies. L’étude QWINT-5 montrera des résultats pour les personnes vivant avec un DT1.
6. Rosenstock J, Bailey T, Connery L et al. Weekly fixed-dose insulin efsitora in type 2 diabetes without previous insulin therapy. N Engl J Med 2025 ; 393 : 325-35.
7. Philis-Tsimikas A, Bergenstal RM, Bailet TS et al. Once-weekly insulin efsitora alfa versus once-daily insulin degludec in adults with type 2 diabetes currently treated with basal insulin (QWINT-3): a phase 3, randomised, non-inferiority trial. Lancet 2025 ; 405 : 2279-89.
8. Blevins T, Dahl D, Pérez Manghi FC et al. Once-weekly insulin efsitora alfa versus once-daily insulin glargine U100 in adults with type 2 diabetes treated with basal and prandial insulin (QWINT-4): a phase 3, randomised, non-inferiority trial. Lancet 2025 ; 405 : 2290-301.
TOP 3 – Les nouveautés dans le domaine des AR-GLP-1
Ces molécules injectables ont montré leur efficacité dans le traitement du DT2, avec des bénéfices cardiovasculaires et une perte de poids. Le développement d’AR-GLP-1 par voie orale reste complexe du fait de contraintes dans l’horaire de la prise du traitement par rapport aux repas et aux boissons, pour favoriser la biodisponibilité et limiter la dégradation du peptide. Des molécules orales non peptidiques sont en cours de développement, et pourraient simplifier la prise du traitement en s’affranchissant de ces contraintes.
L’orforglipron
L’orforglipron est original en ce qu’il s’agit d’un AR-GLP-1 non peptidique, avec une demi-vie de 25 à 68 heures (permettant une prise orale quotidienne), dont la pharmacocinétique n’est pas affectée par les repas ou les liquides.
L’étude ACHIEVE-1 (9)
ACHIEVE-1 concerne 559 personnes vivant avec un DT2, traitées par mesures diététiques et d’activité physique (sans traitements médicamenteux du DT2), dont l’HbA1c est > 7 %. Il s’agit d’une étude randomisée, multicentrique (hors Europe), en double aveugle de 40 semaines testant trois doses d’orforglipron (3, 12, 36 mg, débutant à 1 mg avec augmentation toutes les 4 semaines jusqu’à la cible) et placebo.
Résultats
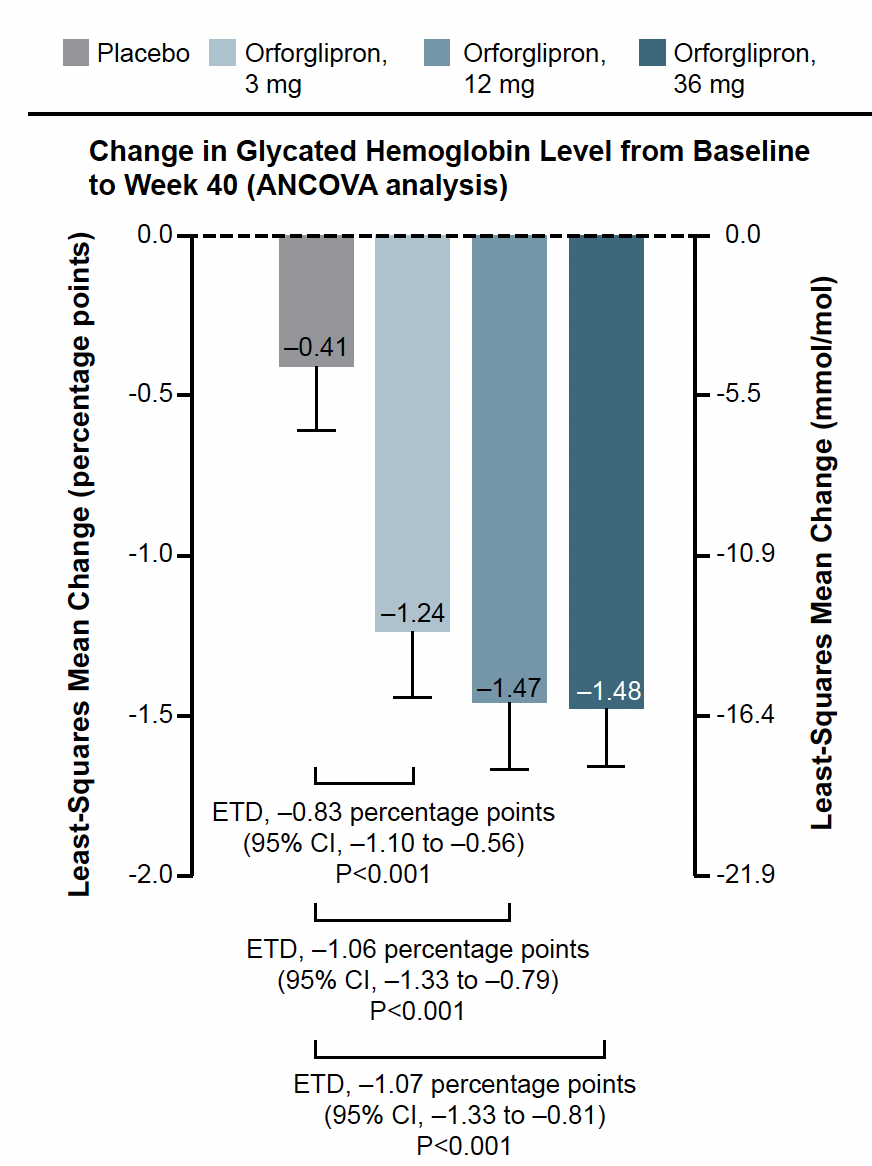
La figure 3 montre la supériorité de chaque dose par rapport au placebo quant à la diminution de l’HbA1c à 40 semaines (critère principal). Au total, 57 à 62 % des personnes recevant l’orforglipron atteignent une HbA1c inférieure à 6,5 % contre 15 % dans le groupe placebo. La perte de poids est d’autant plus importante que la dose est élevée : 4,2 kg (3 mg), 5,2 kg (12 mg) et 7,2 kg (36 mg) contre 1,5 kg (placebo).
Figure 3 – ACHIEVE-1 : évolution de l’HbA1c jusqu’à la semaine 40.
Les effets secondaires sont digestifs, comme attendu, conduisant à l’arrêt du traitement chez 2,2 à 5,7 % des personnes. Il n’y a pas eu d’épisode d’hypoglycémie sévère.
Le cagrilintide en combinaison avec le sémaglutide
Le cagrilintide est un analogue de l’amyline, avec un effet direct satiétogène via une action sur les récepteurs cérébraux de l’amyline. Dans un essai de phase II et à la dose de 2,4 mg, une perte de poids de 9,7 % est observée à 26 semaines, chez des personnes en situation d’obésité.
Le concept des études REDEFINE est de tester la combinaison de sémaglutide et de cagrilintide.
La phase Ib
Une étude de phase Ib montre une perte de poids de 17 % à 20 semaines, pour la combinaison des deux molécules chacune à 2,4 mg.
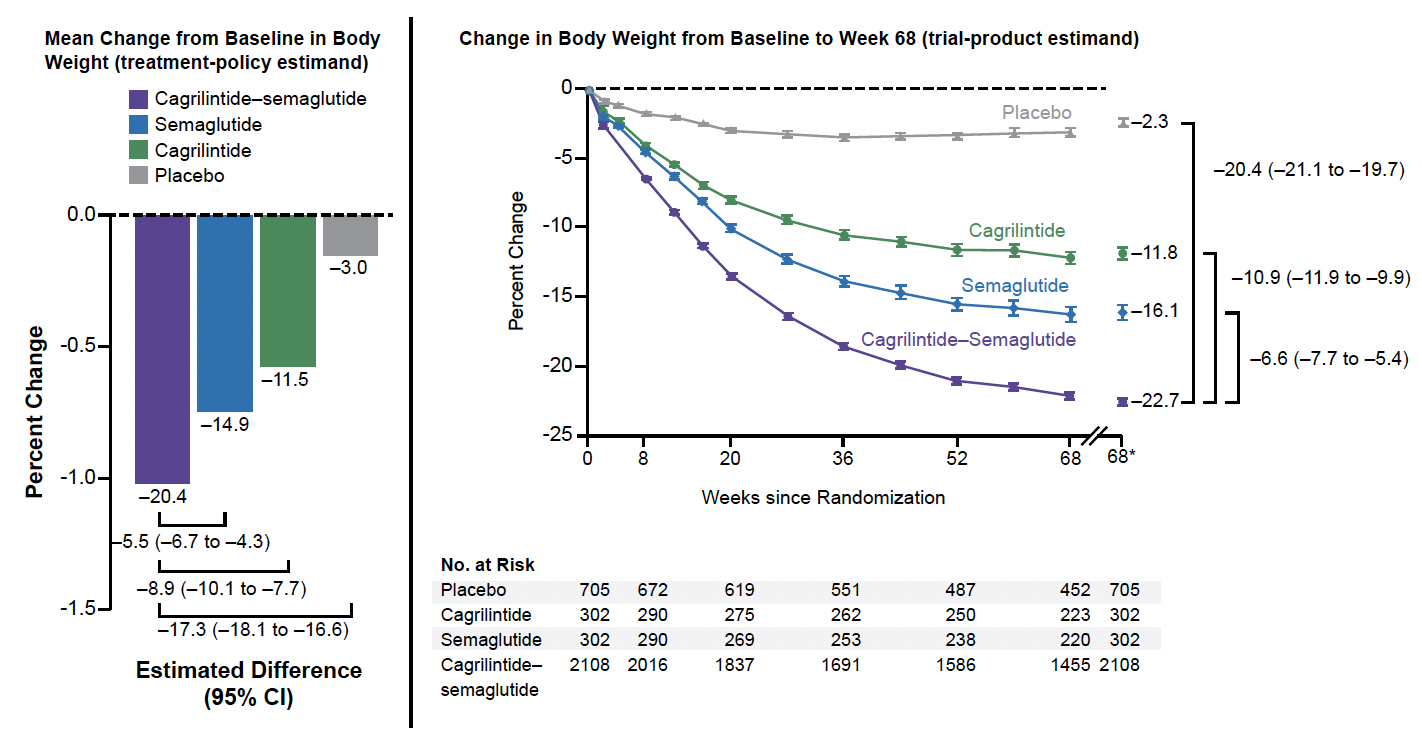
REDEFINE-1 (10)
REDEFINE-1 est une étude de phase III, de 68 semaines, dont l’objectif principal est de valider une perte de poids supérieure avec l’association à 2,4 mg et 2,4 mg versus placebo (et une proportion plus importante de personnes atteignant 5 % de perte de poids). L’étude est randomisée, en double aveugle, et comporte quatre bras au ratio de patients 21:3:3:7 :
• dose 2,4-2,4,
• dose 2,4 sémaglutide,
• dose 2,4 cagrilintide,
• placebo,
en complément des modifications des habitudes de vie.
Les personnes ont un IMC > 30 ou 27 avec une comorbidité, pas de diabète, pas d’antécédent de chirurgie bariatrique. L’escalade de dose se fait toutes les 4 semaines pour atteindre la dose cible à 16 semaines, puis 52 semaines à pleine dose. Au total, 2 108 personnes sont randomisées ; 68 % de femmes, IMC moyen 38.
Résultats
La figure 4 montre la supériorité de l’association et de chaque molécule isolée versus le placebo. Au total, 92 % des personnes traitées par l’association atteignent une perte de poids de 5 %, et les autres cibles sont atteintes par 83 % (plus de 10 %), 75 % (plus de 15 %) et 19 % (plus de 30 %).
Figure 4 – REDEFINE-1 : évolution du poids.
Les effets secondaires les plus fréquents étaient digestifs, surtout pendant la phase d’escalade de dose, conduisant cependant à l’arrêt du traitement chez 5,9 % (association) versus 3,6 % (sémaglutide), 2,6 % (cagrilintide), et 3,5 % (placebo).
REDEFINE-2 (11)
L’étude REDEFINE-2 a le même design pour 1 206 personnes vivant avec un DT2 et un excès de poids (IMC > 27) et une HbA1c entre 7 et 10 %, sans traitement injectable. Le ratio est de 3:1 (association versus placebo). L’objectif principal est de valider la supériorité de l’association (respectivement 2,4 mg pour chaque molécule) par rapport au placebo sur la perte de poids.
Résultats
La perte de poids à 68 semaines est de 13,7 % dans le bras association et de 3,4 % dans le groupe placebo. Une perte de poids de 5 % est obtenue pour 84 % des personnes du bras association et pour 31 % du groupe placebo. À partir d’une valeur d’HbA1c de 8 % au temps 0, la diminution à 68 semaines et de 1,8 % dans le bras association et de 0,4 % dans le bras placebo. Parmi les 199 personnes qui ont bénéficié d’un CGM, le TIR passe de 43,6 (semaine 0) à 86,8 % (semaine 68) dans le bras association et de 41,3 à 51,2 % dans le bras placebo.
Les effets secondaires sont similaires à ceux observés dans l’étude REDEFINE-1 avec arrêt du traitement pour 8,4 % des personnes sous association et 3 % sous placebo.
Si on osait une injection par mois ?
Le maridebart cafraglutide (connu sous le nom de MariTide ou AMG133 ; Amgen) est une molécule dont la demi-vie est de 21 jours, qui combine un AR-GLP1 et un antagoniste du récepteur au GIP. Une étude de phase I de 12 semaines montre une perte de 14,5 % du poids, qui se maintient 150 jours après la dernière injection.
L’étude (12)
Une étude de phase 2 a été présentée à l’ADA et publiée dans le New England Journal of Medicine du mois de juin 2025 (12). Il s’agit d’une étude en double aveugle de 52 semaines, randomisée contre placebo, avec escalade de dose, multinationale, concernant deux populations :
• les personnes vivant avec une obésité,
• et celles vivant avec un DT2.
Au total, il y a trois doses, mais sept groupes en fonction du choix de la stratégie avec ou sans escalade de dose. Le critère principal est la perte de poids. L’étude concerne 592 personnes, 465 dans la partie obésité et 127 dans la partie obésité-diabète.
Résultats
La perte de poids dans la partie obésité est de 12 à 16 %, en fonction des doses, et de 2,5 % dans le bras placebo. La perte de poids dans la partie obésité-diabète est de 8 à 12 % contre 1,7 % dans le bras placebo.
Un peu plus de 200 personnes ont bénéficié d’une mesure de la composition corporelle et, dans les deux groupes traités par cafraglutide, la perte de masse maigre représente 7 à 12 %. La diminution de l’HbA1c peut atteindre 1,6 % à 52 semaines dans le bras obésité-diabète.
Les effets secondaires sont essentiellement digestifs conduisant à l’arrêt du médicament pour 9 % des personnes, et refus d’augmentation de doses pour certains autres.
9. Rosenstock J, Hsia S, Nevarez Ruiz L et al. Orforglipron, an oral small-molecule GLP-1 receptor agonist, in early type 2 diabetes. N Engl J Med 2025 ; Online ahead of print.
10. Garvey WR, Brüher M, Osorto Contreras CK et al. Coadministered cagrilintide and semaglutide in adults with overweight or obesity. N Engl J Med 2025 ; 393 : 635-47.
11. Davies MJ, Bajaj HS, Broholm C et al. Cagrilintide-semaglutide in adults with overweight or obesity and type 2 diabetes. N Engl J Med 2025 ; 393 : 648-59.
12. Jastreboff AM, Ryan DH, Bays HE et al. Once-monthly maridebart cafraglutide for the treatment of obesity — A phase 2 trial. N Engl J Med 2025 ; Online ahead of print.
TOP 4 – Peut-on prévenir la perte de masse musculaire contemporaine de la perte de poids ?
Une perte de poids est souvent associée à une perte de masse maigre, et notamment de masse musculaire, considérée comme l’un des facteurs favorisant la reprise pondérale à l’arrêt du traitement. Cela a été montré avec le sémaglutide et le tirzépatide (13) avec une perte de masse musculaire moyenne de 7 à 10 % de la valeur de départ. La perte importante de masse musculaire affecte la fonction (par exemple, la force), réduit le besoin métabolique du corps, et réduit la masse de tissu insulinosensible. Une masse musculaire réduite est aussi un facteur de risque de mortalité, de toutes causes ou cardiovasculaire.
Le développement de molécules susceptibles de réduire la part musculaire de la perte de poids est donc particulièrement intéressant.
Le bimagrumab
Le bimagrumab est un anticorps monoclonal ciblant les récepteurs de l’activine pour empêcher l’effet de sarcopénie. Une étude réalisée chez les personnes en situation d’obésité avait même montré un gain de masse maigre de 3,6 % dans un contexte de perte de masse grasse de 20 %, c’est-à-dire à lui seul une perte de poids.
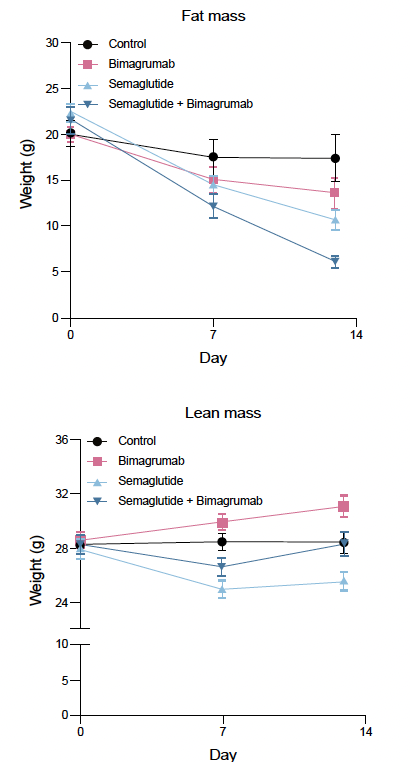
L’étude
Une étude chez la souris obèse (14), combinant le sémaglutide et le bimagrumab, montre une perte de poids de 25 % en 14 jours, dont 70 % sont faits de masse grasse, sans perte de masse maigre (les valeurs à 14 jours étaient similaires au groupe placebo) (Fig. 5).
Figure 5 – Évolution de la masse maigre et de la masse grasse.
En pratique
Des études cliniques chez l’Homme doivent valider ce concept, considérant que plus la personne est âgée et métabolique et plus le risque de sarcopénie est important (voir Mise au point du Pr Boirie dans le prochain numéro).
13. Ritz P. Perte de poids induite par les nouveaux médicaments. Y a-t-il un risque de perte de masse et de fonction musculaires ? Diab Obés 2025 ; 20 : 42-4.
14. Nunn E, Jaiswal N, Gavin M et al. Antibody blockade of activin type II receptors preserves skeletal muscle mass and enhances fat loss during GLP-1 receptor agonism. Mol Metab 2024 : 80 : 101880.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.