Le congrès ATTD (Advanced Technologies & Treatments for Diabetes) s’est tenu à Amsterdam, début mars. C’est l’opportunité de discuter de toutes les technologies, bien sûr des CGM, des boucles, des pompes, mais aussi de l’innovation en matière de préservation de la fonction bêta-cellulaire. C’est un événement très dynamique avec de nombreuses sessions. Avec Bernadette Dijoux, nous avons choisi un certain nombre de présentations pour vous en faire un résumé. Nous vous souhaitons une belle lecture.
Diagnostic, dépistage et identification
Dr Bernadette Dijoux et Pr Patrick Ritz
Le CGM comme outil potentiel de diagnostic du diabète
Les CGM sont devenus indispensables à nos patients diabétiques de type 1 (DT1) sous injections d’insuline ou sous boucle semi-fermée. De nombreux orateurs pendant ce congrès plaident pour une utilisation encore plus large de ces systèmes chez les patients diabétiques de type 2 (DT2), dans le prédiabète ou encore le diabète gestationnel.
Le Pr Stefano Del Prato (Italie), par exemple, lors du symposium Abbott propose l’utilisation du CGM chez :
• les DT2 sous insuline basale ou multi-injections. En effet, même des épisodes flash d’utilisation
(3 mois) peuvent amener à une amélioration de l’HbA1c et du TIR ;
• les DT2 sans traitement médicamenteux, sous règles hygiéno-diététiques. Dans le prédiabète, on note une modification des comportements, car le CGM a un rôle éducatif.
Ces systèmes rendent les patients plus responsables, permettent d’adapter les traitements et d’atteindre les objectifs.
Dans le diabète de type 2
Tadej Battelino (Slovénie), qui a beaucoup travaillé sur les valeurs cibles du CGM, a donné une conférence sur la valeur CGM pour le diagnostic du DT2. L’idée générale est que la glycémie veineuse a une variabilité de 30 % entre différents jours. Il se peut donc que nous passions à côté du diagnostic précoce. Le CGM résoudrait le problème de cette variabilité, car il accumule beaucoup plus de mesures et sur plusieurs jours. La dimension clinique sur laquelle il insiste est l’association entre la glycémie moyenne et la perte de fonction et de volume cérébral. Dans une étude en Grande-Bretagne, il y a un risque relatif multiplié par 2,5 d’altération cognitive si la glycémie s’élève modérément. Cependant, comment obtenir cette glycémie moyenne incluant la variabilité autrement qu’avec le CGM ?
Un consensus est en cours de travail au sujet de l’utilisation du CGM pour le DT2.
Le TING
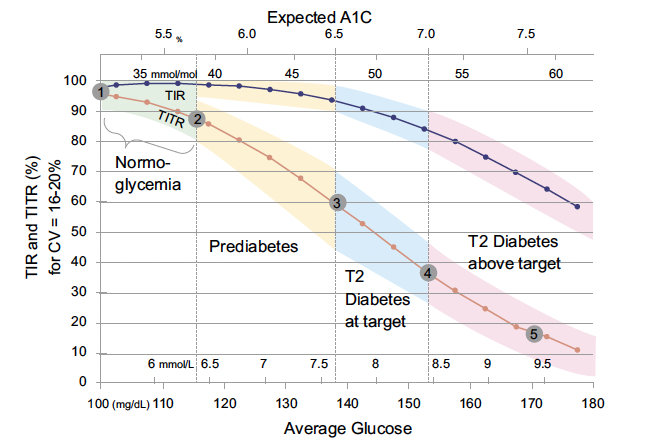
Au-delà, le CGM pourrait servir au diagnostic de diabète. Il faudrait par conséquent définir une “norme” et Tadej Battelino propose le TITR (Time in Tight Range), qu’il renomme TING (Time in Normal Glucose), entre 70 et 140 mg/dl. La figure 1, tirée de Diabetes Technology and Therapeutics (mars 2024), illustre ce concept. Le TIR habituel n’est pas altéré au stade précoce du diabète alors que le TING/TITR l’est. On voit bien l’évolution du pourcentage de temps dans le TIR et le TING à tous les stades d’hyperglycémie, avec une sensibilité plus grande du TING.
Figure 1 – TIR et TITR et CGM.
Dans cette figure, construite avec à la fois des CGM de personnes normales, DT1 et DT2, le TIR (70-180) est moins sensible à la moyenne du glucose que ne l’est le TITR (70-140). Ce dernier diminue déjà dans la zone où l’HbA1c est inférieure à 5,7 % (point 2) ou entre 5,7 et 6,5 % (point 3) alors que le TIR reste au-delà de 95 %.
Le consensus dira si ce TING est retenu pour le diagnostic précoce de DT2 avec peut-être une valeur au-dessus de 5 à 10 % considérée comme pathologique.
Dans les stades très précoces du diabète de type 1
Une nouvelle indication serait les stades très précoces du DT1, comme l’a indiqué le Pr Chantal Mathieu. De nouveaux outils se développent, comme les bases de données ICD10 et SNOMED, aidant à une meilleure identification et classification des stades du DT1. La compréhension du DT1 progresse. Nous savons que le DT1 évolue en quatre stades maintenant identifiés :
• dans les stades 3 et 4, le diabète est révélé par une hyperglycémie objectivable ;
• les stades 1 et 2 sont également reconnus comme des états pathologiques, car des anticorps (AC) y sont présents.
L’utilisation de CGM associé à d’autres marqueurs comme l’HbA1c améliorerait la prédiction d’évolution du stade 2 au 3.
Ainsi, le Pr Chantal Mathieu a rapporté une étude chez 91 enfants AC+, dont 16 sont devenus DT1. De cette étude, il ressort que si le TIR supérieur à 140 est présent plus de 10 % du temps, 80 % des enfants évoluent vers le stade 3 en 1 an.
Un consensus est souhaité pour que le CGM soit un marqueur permettant des recommandations et un seuil de détection du diabète en pratique clinique.
Pour une médecine personnalisée
Le Dr Smadar Shilo a présenté le Human Phenotype Project qui collecte de nombreuses données du patient, dont les données CGM, pour une médecine personnalisée.
Détection précoce du DT1
La recherche se porte sur la détection des stades très précoces du DT1, des années avant que l’insulinothérapie soit utile. Cela permettrait de diminuer la fréquence des hospitalisations pour acidocétoses lors du diagnostic, de former les futurs diabétiques aux premiers signes du diabète et de retarder le passage à l’insuline en utilisant des thérapies ciblant l’immunité.
Rôle des anticorps
La présence des AC est un facteur clé. La nature auto-immune du DT1 est connue. Le système immunitaire attaque la cellule bêta. Des AC spécifiques apparaissent alors dans le sang.
Deux AC ou plus s’ils sont persistants prédisent à 100 % le développement d’un DT1. L’histoire familiale est un fort prédicteur, mais n’existe pas toujours.
Dépistage à grande échelle
Ce dépistage à grande échelle nécessite la participation des systèmes de santé et de l’État, ce qui se fait :
• en Israël (Dr Tal Oron) avec la détection des AC chez les enfants de 9 mois à 5 ans
• et en Italie (Dr Emanuele Bosi) où un programme est intégré dans le système de santé national pour un screening à 2, 6 et 10 ans.
En ce sens, le Pr Chantal Mathieu a rappelé l’étude TEDDY, parue en juillet 2022 dans Diabetologia. Le Pr Krischer a étudié l’évolution de 8 500 enfants sur 9 ans en moyenne en dosant les AC dans deux groupes (avant et après 6 ans) et il a été montré que la nature des AC peut orienter sur l’âge d’apparition du diabète. Le statut HLA était également pris en compte.
Quel est le diabète de ce patient ?
En pratique clinique, il n’est pas toujours facile d’identifier le type de diabète du patient adulte. À noter qu’il y a plus d’adultes diagnostiqués DT1 que d’enfants.
L’approche AABBCC
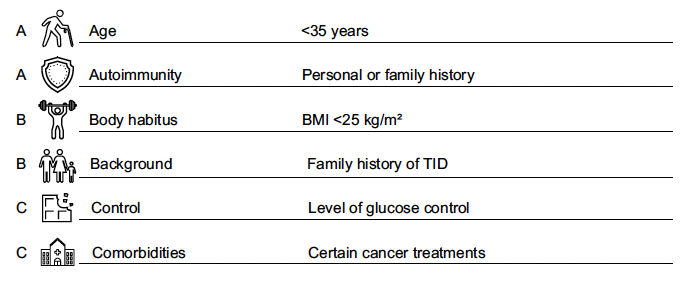
Quand il est difficile de faire la différence entre un DT1 et un DT2 chez l’adulte jeune, pour éviter l’erreur diagnostique, l’ADA propose l’approche AABBCC (Fig. 2).
Figure 2 – L’approche AABBCC pour distinguer un diabète de type 1 selon des caractéristiques cliniques clés.
Il s’agit de prendre en compte :
• age (moins de 35 ans)
• autoimmunity (histoire personnelle et familiale) ;
• body habitus (IMC < 25) ;
• background (histoire familiale de DT1) ;
• control (niveau de contrôle du glucose) ;
• comorbidities (certains traitements de cancers).
Les cinq diabètes
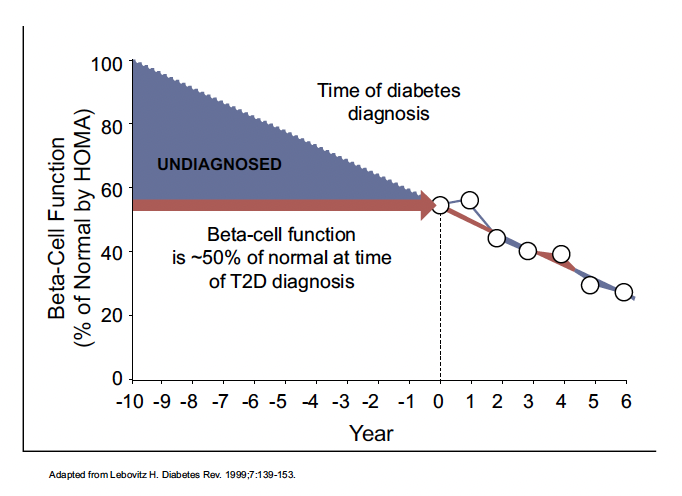
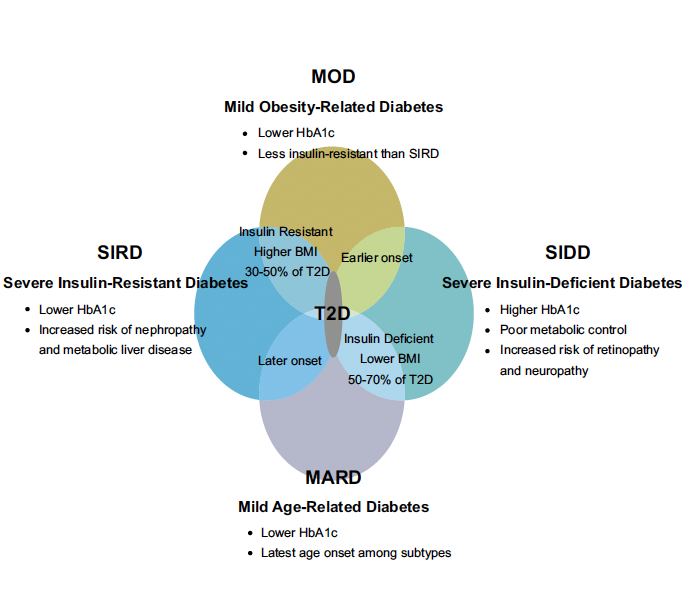
Le Pr Steven Edelman (San Diego, États-Unis) a rappelé l’histoire naturelle du DT2 (Fig. 3) et fait une intervention intéressante sur les cinq types de diabète présentés il y a quelques années (Fig. 4) à partir de deux études indépendantes, ADOPT et RECORD.
Figure 3 – Histoire naturelle du diabète de type 2 : la perte des cellules bêta.
Figure 4 – Les cinq types de diabète.
Le diabète de type 1
• Le SAID (Severe Auto Immune Diabetes) correspond au DT1 et LADA.
Le diabète de type 2
Les quatre autres (SIDD, SIRD, MOD, MARD) correspondent à des DT2. Le DT2 est une pathologie hétérogène dans laquelle on distingue deux grands types de diabète avec des caractéristiques cliniques et des complications différentes.
• Les diabètes insulino-déficients :
- SIDD (Severe Insulin-Deficient Diabetes) (18 %) : IMC moyen 29, HbA1c moyenne 8,3 %, HOMA B 49 %, sévère dysfonction des cellules bêta. Dans ce type, le contrôle métabolique est pauvre, le risque de rétinopathie et de neuropathie est plus élevé.
- MARD (Mild Age-Related Diabetes) (39 %) : IMC moyen 29, HbA1c moyenne 7 %, HOMA B 64 %, faible dysfonction des cellules bêta. Dans ce type, qui débute assez tardivement, le risque de complications serait plus faible.
• Les diabètes insulino-résistants :
- MOD (Mild Obesity-Related Diabetes) (22 %) : IMC moyen 36, HbA1c moyenne 7,2 %, HOMA B 74 %.
- SIRD (Severe Insulin-Resistant Diabetes) (15 %) : IMC moyen 34, HbA1c moyenne 7 %, HOMA B 101 %. Dans ce type, l’insulino-résistance est forte. Le risque de néphropathie et de stéatose hépatique serait plus élevé.
Cette distinction conduirait à plus de précision dans l’indication thérapeutique.
Une nouvelle approche thérapeutique
L’icovaménib, première classe d’inhibiteur de la molécule menin dans le diabète, est à l’étude.
Mécanismes
Menin est une molécule qui va se lier au MAFA, facteur principal de la transcription pour la différenciation de la cellule bêta et agit sur le récepteur du GLP1 pour le freiner.
L’inhibiteur de menin augmente la masse cellulaire bêta et donc la sécrétion d’insuline, augmente la réponse des cellules d’îlots au sémaglutide et au tirzépatide. In vivo, la combinaison avec les agonistes du GLP1 (aGLP1) améliore le contrôle glycémique et la composition corporelle.
Résultats
Une étude randomisée versus placebo en phase IIa a été menée sur des adultes (18-65 ans) DT2 depuis moins de 7 ans ayant une HbA1c entre 7 et 10,5 % et un IMC de 25 à 40, traités par plus de trois antidiabétiques oraux, sauf sulfamides. Tous les participants sont en surpoids ou obèses. Cependant, 40 % sont insulino-déficients SIDD ou MARD. Au bout de 12 semaines, il y a une amélioration significative de l’HbA1c corrélée à une augmentation du peptide C, ce qui valide le mécanisme d’action. Le suivi se prolonge sur 26 semaines.
Ces résultats sont constatés surtout chez les patients SIDD qui seraient la meilleure cible de l’icovaménib (traitement per os). Pour les autres patients, l’association aux aGLP1 résulte en une augmentation de l’effet incrétine et une perte de poids tout en préservant la masse maigre. L’association des produits permet une meilleure tolérance et une diminution des doses d’aGLP1.
• Del Prato S. Introducing new clinical recommendations: transformative insights from CGM for type 2 diabetes. ATTD 2025 : 0940.
• Battelino T. Consensus on the use of CGM in individuals with type 2 diabetes. ATTD 2025 : 0460.
• Dunn TC et al. Is it time to move beyond TIR to TITR? Real-world data from over 20,000 users of continuous glucose monitoring in patients with type 1 and type 2 diabetes. Diabetes Technol Ther 2024 ; 26 : 203-10.
• Mathieu C. Precision medicine in stage 2 type 1 diabetes. ATTD 2025 : 0460.
• Shilo S. Data-Driven approaches in endocrinology: From CGM to omics data. ATTD 2025 : 0460.
• Oron T. Update on ADIR (Antibody Detection Israeli Research) project. ATTD 2025 : 0580.
• Bosi E. Screening of type 1 diabetes and celiac disease of the general pediatric population in Italy: Progress and preliminary results. ATTD 2025 : Parallel session 4.
• Krischer JP. Characteristics of children diagnosed with type 1 diabetes before vs after 6 years of age in the TEDDY cohort study. Diabetologia 2021 ; 64 : 2247-57.
• Edelman S. Precision care in diabetes: understanding patient heterogeneity. ATTD 2025 : 1150.
• Frias JP. Icovamenib: a novel approach to diabetes management. ATTD 2025 : 1150.
Thérapies ciblées sur la cellule bêta
Dr Bernadette Dijoux
Selon le Dr Esther Latres (États-Unis), modératrice de la session, il y a urgence à accélérer les recherches pour maintenir le contrôle glycémique, traiter le diabète et ses complications. Il y a dans le DT1 et le DT2 un déclin de la cellule bêta (CB) et un grand potentiel de traitements pour la faire survivre et la régénérer.
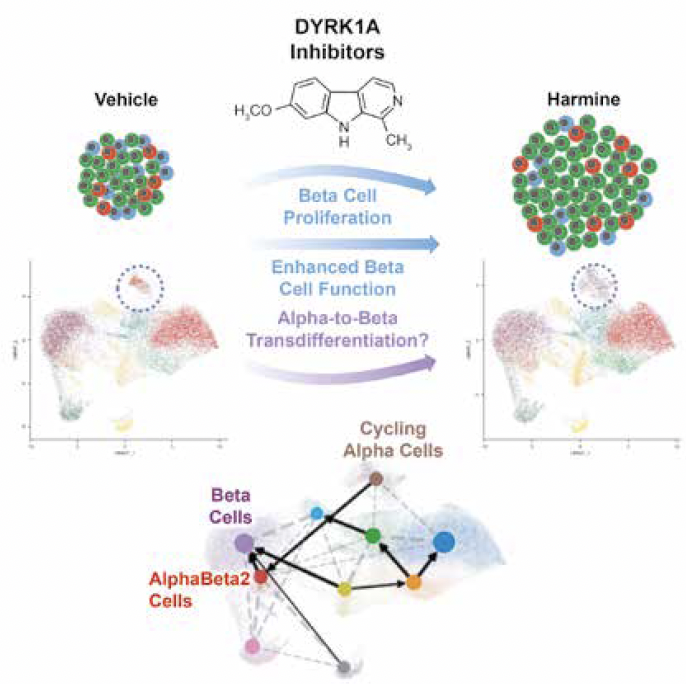
L’harmine
Le Dr Andrew Stewart (Israël) a abordé de petites molécules comme l’harmine qui peuvent induire la réplication des CB et augmenter leur prolifération surtout en association avec les aGLP1 par une action synergique. Ainsi, l’harmine associée à l’exénatide lors d’une transplantation permet une augmentation de la masse cellulaire bêta.
L’harmine est issue d’une plante et est un inhibiteur de la MAO (mono amine oxydase) et du DRK1A qui maintient la quiescence de la cellule. Ce produit pourrait transformer la cellule alpha en CB (Fig. 5).
Figure 5 – L’harmine.
Les macrophages
Le Dr Maria Cristina Nostro (Toronto) a parlé d’optimiser la différenciation et la greffe des cellules souches. L’utilisation des macrophages améliore la différenciation et potentiellement augmente la survie et la fonction des CB transplantées. Il s’agit de générer des cellules d’îlots in vitro et de développer une plateforme de co-culture macrophage-cellule endocrine. Grâce au contact entre ces cellules, les macrophages peuvent promouvoir l’endocrino-genèse. Ils jouent un rôle crucial dans le développement pancréatique.
Les produits suppresseurs des cellules immunes
Le Dr Matthias Hebrok (Munich) a proposé l’utilisation locale de produits suppresseurs des cellules immunes (SynNotch) pour augmenter la survie et la fonctionnalité des CB transplantées sans activer l’immuno-sécrétion systémique.
Cibler la CB endogène est envisageable dans le DT1, car de nombreux adultes gardent un taux de peptide C mesurable des années après le diagnostic. Le DT1 n’est pas qu’auto-immun, il est aussi dû à des anomalies de la CB.
Le TXBIP 100
Le Dr Anath Shalev (Alabama) a présenté le TXNIP 100, un inhibiteur de la molécule TXNIP. Il s’agit d’une approche prometteuse de protection de CB et d’amélioration de l’homéostasie dans le DT1.
Le TXNIP est une cible thérapeutique, car il augmente la réponse au stress glycémique et contribue à l’apoptose de CB.
Le TXNIP100 est spécifique. Contrairement au vérapamil, il ne bloque pas les canaux calciques et présente moins d’effets cardiovasculaires. Il est plus spécifique et plus puissant.
• Au niveau de la CB, il diminue l’inflammation, la mort cellulaire, le stress oxydatif. Il améliore la survie et la fonction de CB.
• Au niveau de la cellule alpha, il diminue la sécrétion de glucagon et donc la production hépatique de glucose.
Son indication initiale était de :
• préserver la CB,
• améliorer l’HbA1c et le TIR,
• diminuer les besoins et les injections d’insuline,
• diminuer les hypoglycémies,
• avoir un effet neutre sur le poids.
Par extension d’utilisation, il peut améliorer la survie de CB et, associé aux interventions sur l’immunité, retarder le passage du stade 1 au 2 et du stade 2 au 3.
Le taux de CB déclinerait plus vite dans le DT1 diagnostiqué chez l’enfant que chez l’adulte.
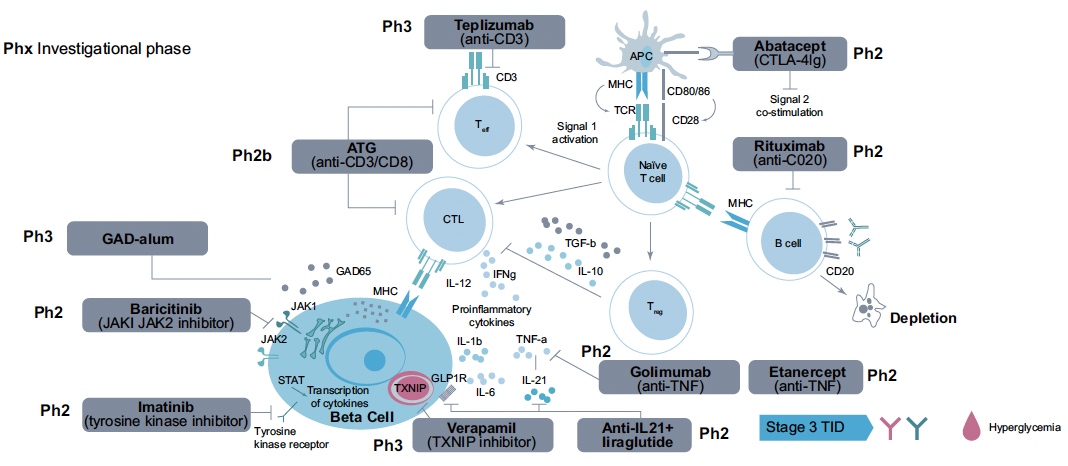
Cibles thérapeutiques dans le diabète de type 1 précoce
Par ailleurs, de nombreuses stratégies thérapeutiques sont proposées au niveau du stade 3 du DT1 (Fig. 6).
Figure 6 – Cibles thérapeutiques dans le diabète de type 1 précoce.
• Stewart AF. Human beta cell regenerative drug therapy: A journey from impossible to possible. ATTD 2025 : 0550.
• Nostro MC. Optimizing differentiation and engraftment of stem cell-derived islets for type 1 diabetes treatment. ATTD 2025 : 0550.
• Hebrok M. Optimizing stem cell derived beta cell function for transplantation. ATTD 2025 : 0550.
• Shalev A. Novel type 1 diabetes therapies targeting endogenous islet cells. ATTD 2025 : 0550.
Boucle fermée et diabète de type 2
Pr Patrick Ritz
Tandem Control-IQ et diabète de type 2
En même temps qu’une publication dans le New England Journal of Medicine, les auteurs rapportent les résultats d’une étude randomisée comparant la boucle fermée et le schéma basal-bolus chez les personnes vivant avec un DT2. Deux études avaient jusqu’alors évalué la boucle fermée dans cette population : CamAPS HX et une étude française avec le même système que pour cette nouvelle étude.
L’étude
L’étude 2IQP concerne 319 personnes sous basal-bolus qui ont été randomisées entre Control-IQ+ system (t:slim X2 pump + Dexcom G6 CGM) et basal-bolus + CGM pendant 13 semaines.
La réduction d’HbA1c est de 0,9 % (8,2-7,3 %) dans le bras boucle fermée versus 0,3 % dans le bras basal-bolus + CGM. De même, le TAR s’améliore de 16 % (3,8 heures), sans modification du TBR. La dose d’insuline est réduite de 8 unités et la qualité du sommeil s’améliore. Même chez les personnes qui n’annoncent pas la composition des repas, la baisse d’HbA1c est similaire.
Cette étude ajoute donc des arguments au fait que le traitement par boucle fermée peut considérablement améliorer l’équilibre glycémique et la qualité de vie chez les personnes vivant avec un DT2
• Messer LH. Study Results: A Randomized, Controlled Trial of Control-IQ+ Technology in Type 2 Diabetes (The 2IQP Study) – Industry Symposium Sponsored by Tandem Diabetes Care. ATTD 2025 : 0350.
• Kudva YC et al. A randomized trial of automated insulin delivery in type 2 diabetes. N Engl J Med 2025 ; 392 : 1801-12.
• Daly AB et al. Fully automated closed-loop insulin delivery in adults with type 2 diabetes: an open-label, single-center, randomized crossover trial. Nat Med 2023 ; 29 : 203-8.
• Reznik Y et al. Should people with type 2 diabetes treated by multiple daily insulin injections with home health care support be switched to hybrid closed-loop? The CLOSE AP+ randomized controlled trial. Diabetes Obes Metab 2024 ; 26 : 622-30.
Le diabète et les femmes
Dr Bernadette Dijoux et Pr Patrick Ritz
Sarah Siegelaar, médaillée de bronze en aviron aux Jeux olympiques d’Athènes en 2004, est une spécialiste des transitions hormonales (grossesse, ménopause) et de la technologie du diabète à Amsterdam. Elle nous a résumé en quelques mots comment être une femme affecte le diabète, en introduction d’un symposium Medtronic « Bridging the Gender Gap in Diabetes Care ». En effet, le DT1 affecte pratiquement autant les femmes que les hommes (ratio relatif : 0,88), mais, il existe des différences entre les hommes et les femmes diabétiques à plusieurs niveaux. Les études dans ce domaine se multiplient.
Effets des changements hormonaux
Les changements hormonaux du cycle affectent la glycémie, qui baisse dans la phase œstrogénique et qui augmente en phase lutéale. La grossesse, bien sûr, affecte le glucose de multiples manières. La ménopause apparaît plus tôt chez les femmes DT1 que chez les femmes sans diabète, est un facteur de gain de poids et de changement de fonctionnement métabolique. L’effet des hormones de substitution est mal connu. Il y a une confusion entre les symptômes de la carence hormonale et ceux des hypoglycémies.
Mécanismes
• Cela s’explique entre autres par le rôle métabolique de l’œstrogène E2 sur l’homéostasie du glucose et de l’énergie. E2 augmente la sensibilité à l’insuline et sa sécrétion, augmente les dépenses énergétiques et diminue la prise alimentaire. Ceci explique pourquoi les glycémies sont plus élevées en phase lutéale prémenstruelle et plus basses en phase folliculaire.
• La contraception orale et la ménopause sont aussi à prendre en compte. Le THS diminuerait l’incidence du diabète, car il améliore la sensibilité et la sécrétion d’insuline.
Les autres différences
Les femmes sont moins bien équilibrées que les hommes en moyenne, accèdent moins à la technologie, et ont 40 % de plus d’événements cardiovasculaires. En outre, les traitements sont moins suivis par les femmes, surtout metformine et aGLP1, qui donneraient plus d’effets secondaires.
L’anxiété, le fardeau et la détresse ainsi que les troubles du comportement alimentaire (TCA) sont plus fréquents chez les femmes.
Les mamans d’enfants DT1
Enfin, les mamans d’enfants DT1 ont un fardeau plus élevé (15 %) que les hommes, réduisent les heures de travail, voire doivent arrêter de travailler, gagnent moins d’argent et dorment moins bien.
Les pistes
Les intervenants dans cette session prônent la création de nouveaux modèles prédictifs incluant le genre. Ils ont notamment rappelé que le diabète gestationnel (sept fois plus de risques) et le SOPK (quatre fois plus de risques) sont des facteurs prédictifs de DT2 préoccupants.
La technologie dans le diabète peut jouer un rôle essentiel dans les différences entre sexes en proposant des solutions personnalisées et adaptables qui permettent d’atténuer les différences hommes-femmes dans la gestion du diabète. Exemple cité : Next-gen de Femtech, un anneau intravaginal qui peut diffuser différents types de produits hormonaux.
Alors, oui la technologie, comme le montre Ohad Cohen, permet d’avoir des indicateurs d’équilibre glycémique similaires chez les hommes et les femmes avec une boucle fermée, mais, d’abord, apprenons aux professionnels de santé toutes ces différences pour accéder aux solutions.
• Siegelaar S. Women and diabetes: exploring the burdens and barriers. ATTD 2025 : 0530.
• Cohen O. Can MiniMed™ 780G system Bridge the Gender Gap? Insight from Clinical Evidence. ATTD 2025 : 0530.
Utilisation de la technologie pendant la grossesse
Dr Bernadette Dijoux
Dans le diabète gestationnel
Le diabète gestationnel (DG) est une pathologie dont la prise en charge est relativement récente
(15 ans) selon le Dr Yariv Yogev (Israël). La difficulté est d’atteindre la cible glycémique. Il n’y a pas pour le moment de consensus. Il faudrait plus de précision sur la définition d’une cible glycémique dans ce cas.
CGM et diabète gestationnel
L’utilisation du CGM dans le DG implique un TITR (70-140) et un TAR de 10 % maximum.
• L’application My Surg R mHealth permettrait ce résultat. Selon une étude sur 1 377 femmes qui l’ont utilisé 3 mois, elle permet une augmentation du TITR et une baisse de TAR en dessous des 10 %.
• Dexcom propose avec le G7 un nouvel algorithme pour la grossesse avec une cible allant de 63 à 140. Il prouve son efficacité et sa sûreté dans tous les cas DT1, DT2 et DG.
Utilisation des boucles pendant la grossesse
L’étude CRISTAL
Le Dr Katrien Benhalima (Belgique) a rapporté l’étude CRISTAL, étude multicentrique utilisant Medtronic 780 et G4.
Il n’y a pas de différence avec un groupe contrôle, mais une amélioration du contrôle nocturne en diminuant les hypoglycémies. Les glucides doivent être renseignés.
L’étude AiDapt
Le Dr Helen Murphy (GB) a présenté l’étude AiDapt avec l’algorithme CamAPS FX qui permet une rapide amélioration des glycémies et peut être utilisé dès le début de la grossesse.
Le TIR augmente et le TAR baisse, ce qui permet de diminuer le nombre de macrosomes et les autres complications. Les résultats sont bons également en post-partum.
Les cibles sont révisables chaque trimestre :
• 1er trimestre : 99 mg/dl ;
• 2e trimestre : 80 à 90 mg/dl ;
• 3e trimestre : 93 mg/dl et la nuit (22 h-7 h) : 80 mg/dl.
Ce système réduit la variabilité : plus faible est la variabilité, meilleurs sont les résultats pour le fœtus.
C’est actuellement l’algorithme le plus performant pour la grossesse diabétique (Fig. 7).
Figure 7 – Boucle fermée et grossesse.
Données de vraie vie
Le Dr Rosa Corcoy (Espagne) a rapporté des données dans la vraie vie. Le TBR diminue réellement, mais la prise de poids est plus importante. Il faudrait établir des protocoles.
Le coût de la boucle reste également un problème.
• Yariv Y. How do you know that your pregnant woman with diabetes is well controlled? ATTD 2025 : 1100.
• Benhalima K. Use of the Medtronic 780G hybrid closed-loop system in type 1 diabetes pregnancy. ATTD 2025 : 1100.
• Murphy HR. The role of CamAPS FX in T1D pregnancy. ATTD 2025 : 1100.
• Corcoy R. Real world experience of hybrid closed-loop use during type 1 diabetes pregnancy: A Spanish perspective. ATTD 2025 : 1100.
Gestion des complications
Pr Patrick Ritz
Un capteur mixte de cétonémie et de glucose
Une conférence de Mark Taub et Ketan Dhataria a abordé cette double mesure proposée par Abbott. L’acidocétose diabétique est une importante cause de mortalité due au diabète avec un incidence entre 1 et 13 %. Le CGM en lui-même réduit l’incidence d’environ 50 %, comment diagnostiquer ces 50 % restants ?
Une méconnaissance de l’acidocétose
Cependant, 32 % des personnes traitées ne connaissent pas ce qu’est l’acidocétose diabétique, en particulier ne se testent pas en cas de fièvre aiguë (45 % des personnes) et moins de 20 % le font si le glucose est au-delà de 300 mg/dl (c’est le résultat de l’étude STOP DKA).
Un capteur de cétonémie intégrée
Abbott propose donc un CKM (Continuous Ketone Monitoring) intégré dans le CGM FreeStyle. Les premiers retours d’expérience sont que l’indicateur cétone peut changer plus vite que le glucose et pourrait permettre de prendre des décisions plus vite, informant plus tôt d’un arrêt de pompe, d’une obstruction de cathéter, d’un retentissement d’une maladie aiguë.
Cependant, faut-il généraliser ce double monitoring dans un contexte où seuls les médecins spécialisés sont à l’aise avec cet indicateur, peu de patients comprennent ce que les chiffres veulent dire, et c’est parfois compliqué en cas de jeûne… une formation renforcée sera sans doute nécessaire, en attendant des preuves et un champ de remboursement.
• Taub M, Dhatariya K. Innovating DKA management with continuous ketone monitoring and early warnings. ATTD 2025 : 0940.
• Goldenberg RM et al. Sodium-glucose co-transporter inhibitors, their role in type 1 diabetes treatment and a risk mitigation strategy for preventing diabetic ketoacidosis: The STOP DKA Protocol. Diabetes Obes Metab 2019 ; 21 : 2192-202.
Hot from the oven
Pr Patrick Ritz
Une session spéciale a parlé des “actualités brûlantes”, en quelques mots.
• L’étude CLOSE IT comparait les hybrid closed loop (HCL) et les fully closed loop (FCL) dans une étude randomisée pour des personnes adultes vivant avec un DT1 (pompe Ypsomed, capteur Dexcom G6 et algorithme open source). L’objectif était de montrer qu’il n’y avait pas d’infériorité de la FCL (sans annoncer les repas). C’est ce qui a été validé, ni le TIR, ni le TBR, ni le TAR ou la moyenne du glucose ne diffèrent entre les deux groupes. Le Pr Neale Cohen (Australie), qui a présenté les résultats, a précisé qu’il y avait eu un peu moins de bolus dans la FCL, une consommation de glucides identique dans les deux groupes et un algorithme particulièrement travaillé pour cela.
• L’étude PROTECT, déjà publiée, avait pour objet de démontrer la capacité du teplizumab à protéger la fonction bêta-cellulaire tôt après la découverte du DT1 (stade 3). La présentation, par Colin Dayan (Royaume-Uni), concernait une étude ancillaire et des résultats complémentaires pour 217 personnes, dont 111 sous placebo, avec le Dexcom G6 et traités par multi-injections, par pompe ou par boucle fermée. La dose d’insuline quotidienne est réduite d’environ 20-25 % dans le bras teplizumab, le TIR est augmenté de 6,2 %, soit 94 minutes. Le TAR est réduit de 98 minutes par jour et il n’y a pas de différence de TBR.
• Dexcom propose un nouveau capteur, le G7, pour une analyse des données sur 15 jours. Sa comparaison à la glycémie veineuse montre une MARD (mean absolute relative difference) de 8 %, ce qui est conforme aux recommandations de la FDA pour le CGM. Dans 95 % des cas, les alertes au-delà de 240 mg/dl étaient validées, et 82 % des alertes sous 70 mg/dl. Il s’agissait d’une étude sur des personnes vivant avec un DT1 ou DT2, présentée par Satish K. Garg (États-Unis).
• Cohen N. CLOSE IT – Results from a randomized controlled fully closed loop trial. ATTD 2025 : 0450.
• Dayan C. Effect of Teplizumab on time in range in newly diagnosed type 1 diabetes: A PROTECT study per-protocol analysis. ATTD 2025 : 0450.
• Ramos EL et al. Teplizumab and β-cell function in newly diagnosed type 1 diabetes. N Engl J Med 2023 ; 389 : 2151-61.
• Garg SK. ONLINE FIRST RELEASE – Performance and accuracy of 15-day G7 Continuous Glucose Monitor. ATTD 2025 : 0450.
Les jumeaux numériques
Pr Patrick Ritz
Une session spéciale de l’ATTD était consacrée aux jumeaux numériques (JN), probable évolution de la prise en charge personnelle et personnalisée des patients.
Qu’est-ce qu’un jumeau numérique ?
C’est un modèle mathématique destiné à simplifier la représentation d’une situation. Dans notre cas, tous les facteurs à prendre en compte pour décrire la glycémie à un moment. Il s’agit donc de répliquer virtuellement pour simuler ce qui s’est passé et ce qui va se passer et prendre une décision. C’est ce qu’a expliqué Giacomo Cappon de l’université de Padova, Italie.
Il y a donc un modèle mathématique, qui peut avoir deux origines.
Modélisation de la glycémie selon la physiologie
La glycémie est modélisée à partir de ce que nous savons de la physiologie, par exemple la glycémie au temps n+1 est fonction de la quantité de glucose consommée (Q) et absorbée, de la dose d’insuline (Ins) et de l’efficacité de cette dose.
Ainsi gly (t+1) = d*Q + k*Ins ; les facteurs d et k (absorption et efficacité) varient d’une personne à l’autre et d’un moment à l’autre pour une personne. Si nous parvenons au modèle adapté à la personne, nous pouvons décrire presque exactement l’évolution du glucose du CGM.
Cela suppose un modèle fondé sur des connaissances exactes de la physiologie, intégrant :
• les nouvelles connaissances (par exemple, l’index glycémique du riz pré-cuit n’est pas le même que celui du riz “nature”),
• l’influence d’autres paramètres (la glycémie change avec des médicaments en plus, agonistes du GLP1, corticoïdes… ; les omics… de la personne influencent sa physiologie, les effets connus de l’exercice).
On peut donc imaginer des modèles complexes qui permettraient de parfaitement décrire la physiologie.
Simulation de la glycémie par l’intelligence artificielle
La glycémie est simulée à partir d’une intelligence artificielle (IA), qui analyse et reproduit les données qui lui sont confiées sans hypothèse de physiologie (unmodeled data). Plus on nourrit l’IA avec des données, plus elle a de chance de réussir.
La modélisation mathématique est plus “crédible” pour les cliniciens, mais peut-être un peu trop rigide. La simulation par l’IA apparaît sans limite, c’est automatique (pas besoin d’écrire des équations), la machine peut apprendre (machine learning), la confiance des cliniciens et des patients doit être respectée, il faut beaucoup de données et cela pose des questions d’éthique et de régulation.
L’évolution est d’avoir un modèle et d’introduire de la simulation IA pour combiner les deux.
Ainsi, si la simulation est possible, en ajustant certains paramètres bolus, débits, annonce d’exercice et si la prédiction est hors de la cible (hypo…), la personne (accompagnant soignant ou patient) va pouvoir changer de décision, en tester d’autres et choisir la plus appropriée. Il ne s’agit pas seulement de faire une hypothèse (si… alors je risque de…), mais de simuler ce qui très probablement va se passer en le visualisant sur une courbe virtuelle de CGM.
C’est une promesse…. Pour cela, il faudra que nous ayons confiance, que les modèles intègrent toutes les connaissances (physiologie…) au fur et à mesure, et que la personnalisation soit parfaite.
Vers où allons-nous ?
Les modèles mathématiques pourront intégrer autant de connaissances que nous en gagnerons, les JN vont donc évoluer.
L’hétérogénéité des physiologies individuelles, des réponses comportementales supposent de “personnaliser” les adaptations. C’est ce que devraient permettre les JN. Les signaux inhabituels (sur le CGM) sont bien plus souvent le reflet d’“adaptations personnelles” que de défauts techniques, cela a été répété de très nombreuses fois par les conférenciers. Ces adaptations personnelles ne sont pas faciles à modéliser.
Les entrepôts de données permettront d’aller dans le cloud, de trouver son jumeau et de tester ce qui pourra se passer dans les jours suivants. Si je “trouve” mon jumeau, je peux prédire ce qui va se passer sur un ou plusieurs jours, si je… C’est l’idée du jumeau le plus “proche” qui rend le modèle plus précis.
Est-ce que nous avons des validations ?
L’étude ABC
Le Pr Boris Kovatchev de l’Université de Virginie a expliqué l’étude ABC (Adaptative Behavior Control). Ce sont 72 personnes vivant avec un DT1, qui, en cross-over, ont eu :
• soit la boucle fermée (Tandem Control-IQ), puis un accompagnement par un soignant pour améliorer les réglages (4 semaines), puis 16 semaines d’utilisation de JN pour adapter “son comportement” à partir des prédictions,
• soit, à l’inverse, les 16 semaines d’utilisation de JN, puis la boucle fermée, puis l’accompagnement.
Résultats
Le TIR augmente de façon similaire dans les deux groupes, jusqu’à 77-78 %, mais dans le bras avec le jumeau “d’abord”, cette augmentation est immédiate, alors qu’elle est décalée à l’utilisation du jumeau dans le bras commençant par la boucle fermée. Et cela était d’autant plus marqué que l’HbA1c était > 7,5 % au départ. Il semble donc que le jumeau numérique soit une possibilité d’apprentissage (éducation) supplémentaire.
Le conférencier suggère que les JN ont déjà permis de ne plus faire des études précliniques sur les animaux (avec cette technologie, les JN ont permis de faire in silico ce qui était fait chez les animaux et la FDA a validé cela en 2008). Cela pourrait peut-être aussi prédire des issues au-delà des essais réalisés aujourd’hui. Imaginons un essai avec des objectifs à 2 ans, validés et publiés (par exemple le TIR). Il deviendra possible de prédire ce qu’aurait été un indicateur supplémentaire (le risque et la fréquence d’une complication, à plus long terme) en utilisant les JN des personnes incluses dans l’essai initial, voire les jumeaux des essais sur les mêmes complications. Aurons-nous confiance en ces simulations ? C’est une vraie question !!!
Ce dont nous avons encore besoin
Les JN sont donc des innovations avec beaucoup de perspectives pour “personnaliser le plus possible” les prédictions et les adaptations. Cela peut être un outil d’éducation et de suggestion d’adaptation comportementale (la personne peut prédire avec le jumeau et l’application peut suggérer des changements). L’intégration de toutes les recherches de physiologie devrait améliorer les modèles, et l’IA devrait permettre de personnaliser encore plus avec la richesse des données collectées et disponibles. Cela devrait permettre de meilleurs résultats (TIR, HbA1c) et il reste à montrer que cela réduit les complications. Il nous faut apprendre à gérer les personnes qui ne sont pas geek, qui ne souhaitent pas utiliser ces techniques, et ne pas induire de fardeau supplémentaire à ces traitements.
• Cappon G. Creating digital twins: Model-driven and AI methods – An introduction. ATTD 2025 : 0610.
• El Fathi A. Digital twins, replay simulation, and decision support. ATTD 2025 : 0610.
• Kovatchev B. How digital twins can enhance clinical trials. ATTD 2025 : 0610.
Quelques nouveautés thérapeutiques
Dr Bernadette Dijoux
• STELO (Dexcom) est un capteur pour les DT2 sans insuline, d’une durée de 15 jours avec un enregistrement continu des données visibles sur la plateforme G7 (Fig. 8).
Figure 8 – STELO, un capteur pour le diabète de type 2 sans insuline.
• OURA RING 4 : Oura s’associe à Dexcom pour intégrer le glucose à sa bague connectée. La glycémie pourra être couplée aux données déjà présentes dans cette bague (sommeil, activité, fréquence cardiaque…) (Fig. 9). Les utilisateurs de G7 et de STELO auront également accès à l’application OURA et pourront suivre toutes leurs données.
Figure 9 – OURA RING 4, bague connectée.
• Dexcom G7 et ONE PLUS fonctionnent avec les stylos connectés Novopen 6 et Novopen Echo Plus.
Les auteurs déclarent ne pas avoir de liens d’intérêt en rapport avec cet article.