L’association d’une obésité au diabète de type 1 (DT1) n’est plus une situation exceptionnelle. Lorsque l’IMC est supérieur à 35 kg/m², le recours à la chirurgie bariatrique est parfois envisagé dans le cadre de la décision médicale partagée, avec, comme principal frein, le risque de déséquilibre glycémique ultérieur en lien avec les modifications anatomiques du tractus digestif et des changements dans le mode d’alimentation. Encore trop peu de données sont disponibles dans la littérature et le rapport bénéfice/risque de la chirurgie bariatrique chez les patients vivant avec un DT1 est toujours sujet à controverse.
Prévalence du surpoids et de l’obésité chez les patients vivant avec un DT1
La prévalence de l’obésité chez les adultes a plus que doublé au cours des 30 dernières années, en lien avec l’évolution défavorable des modes alimentaires et l’augmentation de la sédentarité. Les patients vivant avec un DT1 ne sont pas épargnés par cette épidémie ; ils seraient même plus enclins à développer un surpoids ou une obésité. En effet, des études récentes ont montré que le taux d’obésité dans cette population pourrait surpasser celui retrouvé dans la population générale. En Suède, plus de 55 % des patients vivant avec un DT1 seraient en surpoids et plus de 18 % en situation d’obésité (1). Des résultats similaires sont retrouvés dans d’autres pays d’Europe (Belgique, Autriche), mais aussi aux États-Unis (2).
“Diabète double” ou diabète de type X : une population à haut risque
Une nouvelle entité clinique
Cette augmentation de la prévalence du surpoids et de l’obésité chez les patients vivant avec un DT1 tend à faire disparaître la distinction clinique fondée sur l’indice de masse corporelle (IMC) entre le DT1 et le diabète de type 2 (DT2), désormais bien trop simpliste.
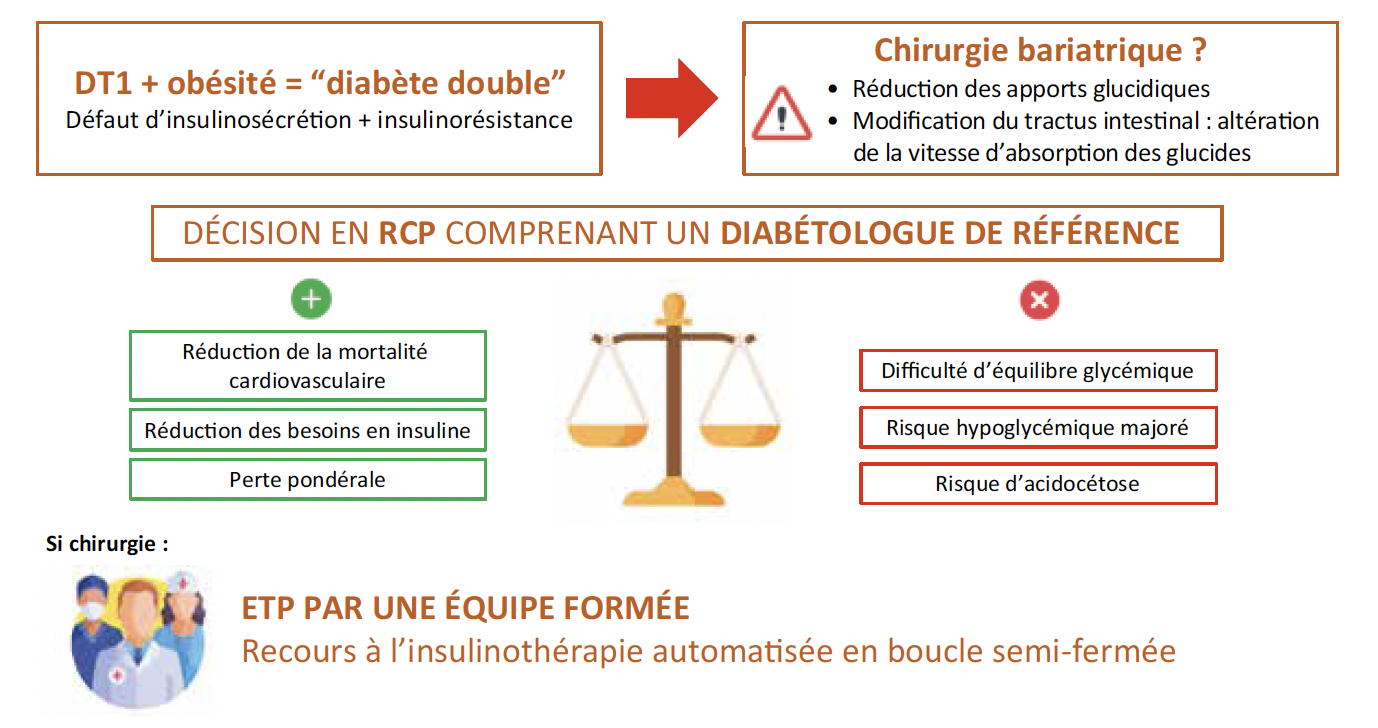
On assiste ainsi à l’émergence d’une nouvelle entité clinique nommée “diabète double” ou “diabète de type X”, où s’associent un défaut d’insulinosécrétion par mécanisme auto-immun et une insulinorésistance.
Ces patients sont porteurs d’un DT1 et présentent des caractéristiques retrouvées dans le DT2, à savoir un surpoids ou une obésité, des antécédents familiaux de DT2 et/ou des stigmates d’insulinorésistance et des comorbidités associées (hypertension artérielle, dyslipidémie).
Une population plus à risque
Comparativement à des patients vivant avec un DT1, ils sont plus à risque de développer des complications macrovasculaires, avec notamment une plus grande prévalence de maladie coronarienne (8 versus 3 % ; p < 0,0001), mais aussi des complications microvasculaires (16,2 % de risque de développer une rétinopathie versus 12,4 % ; p < 0,0001). (3). Ce pronostic péjoratif impose, en plus du contrôle optimal des facteurs de risque associés, un contrôle glycémique optimal, difficile à obtenir dans un contexte d’insulinorésistance où les doses d’insuline doivent souvent être majorées, avec comme principale conséquence des difficultés à perdre du poids, voire une prise pondérale supplémentaire en raison de l’effet anabolique de l’insuline, créant un véritable cercle vicieux.
La prise en charge des patients vivant avec ce diabète double représente donc un véritable défi thérapeutique pour le clinicien.
Les nouvelles options thérapeutiques
De nouvelles options de prise en charge sont à considérer, notamment le recours à des anti-hyperglycémiants oraux ou injectables (adjonction de metformine et/ou d’un agoniste d’un récepteur du GLP-1 (a-GLP1) à une insulinothérapie intensive par exemple), mais également, en cas d’obésité de grade 2 ou 3, l’éventualité d’une chirurgie bariatrique, même si les données de la littérature sont peu nombreuses sur ce sujet controversé.
Les bénéfices de la chirurgie bariatrique dans le diabète double
Réduction de l’IMC
Czupryniak et al. (4) ont été les premiers, en 2010, à rapporter une réduction significative de l’IMC après chirurgie bariatrique chez des patients présentant un DT1. Les études (de petite taille) et méta-analyses réalisées par la suite sont toutes concordantes avec ce premier résultat, et même s’il existe généralement une reprise pondérale à distance de la chirurgie, une baisse significative de l’IMC, allant de 9 à 13 kg/m² selon les études (5, 6), est retrouvée à long terme.
Diminution des besoins en insuline
Dans ces études, une diminution significative des besoins en insuline est également retrouvée chez la majorité des patients, quelle que soit la durée du suivi, avec une réduction de près de 50 % de la dose totale quotidienne d’insuline pouvant être observée durant la 1re année suivant la chirurgie, concernant aussi bien l’insuline basale que les bolus préprandiaux (7). Cette baisse des besoins en insuline est cependant moins importante que celle retrouvée après chirurgie bariatrique chez les patients présentant un DT2 insulino-traité (8).
Amélioration des facteurs de risque liés à l’obésité
Complications cardiovasculaires et troubles lipidiques
L’effet sur les facteurs de risque associés à l’obésité semble superposable à celui retrouvé dans le DT2, avec notamment une amélioration de l’hypertension artérielle et des troubles lipidiques, permettant un allègement, voire un arrêt, des thérapeutiques (7). La correction de ces troubles métaboliques participe à la réduction du risque cardiovasculaire, objectif thérapeutique principal dans la prise en charge du diabète double. Une étude nationale de cohorte suédoise a notamment démontré que le recours à la chirurgie bariatrique chez les individus vivant avec une obésité et un DT1 réduisait l’incidence de la mortalité cardiovasculaire (1). Dans cette étude, de grande envergure, une analyse rétrospective sur 10 ans était réalisée auprès de 774 sujets vivant avec un DT1 et une obésité, dont 387 ayant subi une chirurgie bariatrique de type bypass. L’incidence des maladies cardiovasculaires et de la mortalité cardiovasculaire, à 10 ans, était significativement plus faible dans le groupe chirurgie bariatrique (HR : 0,43 ; IC 95 % : 0,2-0,9 ; p = 0,026 et HR : 0,15 ; IC 95 % : 0,03-0,68 ; p = 0,013).
Complications microvasculaires
Concernant les complications de type microvasculaire, il semble exister une tendance à la réduction de l’hyperfiltration glomérulaire et de l’albuminurie, pouvant ralentir la progression de la maladie rénale chronique (9), mais encore trop peu de données sont retrouvées dans la littérature.
Des résultats mitigés sur l’HbA1c
Les données divergent quant à l’équilibre glycémique en post-opératoire. En dépit d’une réduction nette des besoins en insuline, la plupart des études ne retrouvent qu’une amélioration très modérée de l’HbA1c, avec une réduction en moyenne de 0,64 à 0,93 % (5, 6), s’estompant avec le temps et la reprise de poids, sans atteinte systématique de l’objectif cible d’HbA1c ≤ 7 %. Il est même rapporté, par certains auteurs, une augmentation de l’HbA1c en post-opératoire tardif. Ces divergences sur l’évolution de l’HbA1c en post-opératoire peuvent s’expliquer par le faible effectif des populations étudiées limitant l’extrapolation des résultats obtenus. Toutefois, l’absence d’amélioration de l’HbA1c est probablement le reflet de l’absence de cellules bêta, limitant le bénéfice induit sur l’insulinosécrétion par l’augmentation des taux de GLP-1 en post-opératoire (10).
De plus, le recours à d’autres indicateurs d’équilibre glycémique tels que le temps dans la cible (Time in Range, TIR), le temps passé en hypoglycémie (TBR, Time Below Range) ou encore le coefficient de variabilité (CV) pourrait permettre d’affiner l’évaluation de l’équilibre glycémique post-opératoire.
La chirurgie bariatrique dans le DT1 : source de variabilité glycémique ?
L’augmentation du risque de complications aiguës (hypoglycémie, acidocétose diabétique) est l’une des préoccupations majeures chez le patient vivant avec un DT1, après chirurgie bariatrique. L’équilibre glycémique est donc un vrai défi en post-opératoire.
Les mécanismes impliqués
Plusieurs mécanismes expliquent les difficultés rencontrées.
• Les modifications anatomiques du tractus digestif vont altérer l’absorption glucidique, compliquant la titration des doses d’insuline. L’arrivée rapide des glucides au niveau du jéjunum entraîne une augmentation de la vitesse d’absorption du glucose et du pic maximal de glucose, creusant ainsi le décalage avec l’effet de l’insuline exogène, ce qui favorise la survenue d’événements hypoglycémiques.
• Les apports alimentaires variables, et très faibles dans les premiers temps, les collations glucidiques et sans fibres et les potentiels vomissements rendent difficile le calcul des besoins en insuline au cours du premier mois post-opératoire.
• De plus, la diminution pondérale entraîne une diminution rapide de l’insulinorésistance d’où la nécessité d’adapter continuellement les ratios d’insuline.
Les risques
Le risque hypoglycémique
Le risque hypoglycémique varie de 18 à 70 % selon les auteurs (10) et est d’autant plus important chez les patients présentant des vomissements ou chez lesquels les doses d’insuline n’ont pas été réévaluées précocement. A contrario, il n’est pas retrouvé de majoration du risque d’hypoglycémie selon le type de chirurgie (7, 9), mais la majorité des études concernent des chirurgies par bypass (80 contre 14 % pour la sleeve gastrectomie).
Le risque d’acidocétose diabétique
Les variabilités glycémiques post-chirurgicales et les difficultés de titration de l’insuline participent aussi à une augmentation du risque d’acidocétose diabétique, dont l’incidence en post-opératoire serait de 15 à 25 % (11). Parmi les facteurs favorisants, on peut citer :
• les hyperglycémies pré-opératoires, favorisées par le stress anesthésique et chirurgical, l’absence d’ajustement des doses d’insuline en péri-opératoire,
• les infections post-opératoires,
• l’anorexie
• et la déshydratation post-opératoire.
Une mauvaise gestion des traitements en post-opératoire, souvent secondaire à une mauvaise connaissance de la pathologie par des équipes non formées (amalgame fait entre DT1 et DT2), peut également être source de complication aiguë.
En pratique
L’éducation thérapeutique et l’information
L’éducation des patients par une équipe de diabétologie ayant une expérience de la chirurgie bariatrique dans le DT1 est donc primordiale. Il semble indispensable que le patient soit averti de ces difficultés, qu’il soit équipé d’un système de mesure du glucose en continu, et également formé au comptage des glucides et, si possible, à l’insulinothérapie fonctionnelle.
La gestion des doses d’insuline
L’adaptation des doses d’insuline doit être anticipée et l’idéal est de mettre en place une télésurveillance glycémique.
Un suivi rapproché avant et après la chirurgie, par un diabétologue, est donc la clé dans l’obtention d’un bon équilibre glycémique en péri-opératoire.
Les progrès technologiques
Par ailleurs, les progrès technologiques récents en diabétologie, avec notamment l’avènement des systèmes d’insulinothérapie automatisée en boucle semi-fermée, offrent des possibilités supplémentaires dans l’équilibre glycémique du patient vivant avec un DT1. Ces systèmes pourraient apporter à la fois une sécurité en post-opératoire, mais également une solution thérapeutique pérenne au long cours, en limitant la variabilité glycémique (12).
Le suivi ophtalmologique
De par cette variabilité glycémique, inhérente à la période post-opératoire, le suivi ophtalmologique doit être lui aussi rapproché. Toutefois, si le risque ophtalmologique post-opératoire existe, il est limité par l’absence de baisse rapide et brutale de l’HbA1c. Attention cependant aux sujets dont l’équilibre glycémique pré-opératoire était précaire ou dont le statut ophtalmologique était déjà altéré en pré-opératoire (13).
Retentissement sur la qualité de vie, troubles psychologiques et conduites addictives
Comme déjà constaté dans d’autres populations, la période post-opératoire peut favoriser la survenue ou la réapparition de troubles psychiatriques ainsi que le risque suicidaire.
Il est aussi constaté une augmentation significative des conduites addictives, qui viennent parfois se substituer à la prise alimentaire antérieure. Le risque de développer une dépendance à l’alcool est d’autant plus dangereux qu’elle concerne des patients dont les modifications anatomiques accélèrent l’absorption de l’alcool majorant ainsi le risque d’hypoglycémie. Une évaluation et un suivi psychologique/psychiatrique sont donc essentiels.
Par ailleurs, l’effet sur la qualité de vie n’a pas été évalué dans cette population particulière.
Est-ce que la perte pondérale et la réduction des doses d’insuline seraient des facteurs d’amélioration ou est-ce que l’augmentation de la variabilité glycémique et les difficultés d’équilibre pourraient avoir une incidence négative sur la qualité de vie des patients ? Des enquêtes de satisfaction sont nécessaires pour pouvoir répondre à ces questions.
Figure 1 – Chirurgie bariatrique dans le diabète de type 1 : les points essentiels.
Les auteurs déclarent ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Höskuldsdóttir G, Ekelund J, Miftaraj M et al. Potential benefits and harms of gastric bypass surgery in obese individuals with type 1 diabetes: a nationwide, matched, observational cohort study. Diabetes Care 2020 ; 43 : 3079-85.
2. Kueh MTW, Chew NWS, Al-Ozairi E, le Roux CW. The emergence of obesity in type 1 diabetes. Int J Obes 2024 ; 48 : 289-301.
3. Merger SR, Kerner W, Stadler M et al. Prevalence and comorbidities of double diabetes. Diabetes Res Clin Pract 2016 ; 119 : 48-56.
4. Czupryniak L, Wiszniewski M, Szymański D et al. Long-term results of gastric bypass surgery in morbidly obese type 1 diabetes patients. Obes Surg 2010 ; 20 : 506-8.
5. Ashrafian H, Harling L, Toma T et al. Type 1 diabetes mellitus and bariatric surgery: a systematic review and meta-analysis. Obes Surg 2016 ; 26 : 1697-704.
6. Chow A, Switzer NJ, Dang J et al. A systematic review and meta-analysis of outcomes for type 1 diabetes after bariatric surgery. J Obes 2016 ; 2016 : 1-7.
7. Vilarrasa N, Rubio MA, Miñambres I et al. Long-term outcomes in patients with morbid obesity and type 1 diabetes undergoing bariatric surgery. Obes Surg 2017 ; 27 : 856-63.
8. Kassel LE, Berei JJ, Pitlick JM, Rand JE. Insulin dose adjustment following bariatric surgery, a review of available literature. J Diabetes Sci Technol 2022 ; 16 : 1560-6.
9. Mohammed N, Buckley A, Elsheikh M et al. Bariatric surgery in the treatment of patients with obesity and type 1 diabetes: A retrospective study of clinical data. Diabetes Obes Metab 2021 ; 23 : 1562-70.
10. Jin H, Kim SH, Chung Y et al. Effect of sleeve gastrectomy on morbid obesity with type 1 diabetes mellitus; case series, literature review and meta-analysis. J Metab Bariatr Surg 2020 ; 9 : 52-60.
11. Korakas E, Kountouri A, Raptis A et al. Bariatric surgery and type 1 diabetes: unanswered questions. Front Endocrinol 2020 ; 11 : 525909.
12. Cornu E, Gaulier C, Juttet P et al. Closed-loop insulin delivery may help prevent metabolic complications during bariatric surgery in patients with type 1 diabetes: a case report. Diabetes Technol Ther 2024 ; 26 : 279-82.
13. Bain SC, Klufas MA, Ho A, Matthews DR. Worsening of diabetic retinopathy with rapid improvement in systemic glucose control: A review. Diabetes Obes Metab 2019 ; 21 : 454-66.