Résumé
Le diabète GCK-MODY se caractérise par une hyperglycémie à jeun modérée liée à un variant du gène GCK codant pour la glucokinase qui contrôle la première étape de l’insulinosécrétion en réponse au glucose. Pendant la grossesse, il existe un risque de macrosomie par stimulation de l’insulinosécrétion fœtale en réponse à l’hyperglycémie maternelle uniquement quand l’enfant n’a pas hérité du variant maternel (50 % des cas). Ainsi, le traitement de l’hyperglycémie maternelle n’est nécessaire que dans cette situation et pourrait entraîner un risque de retard de croissance si l’enfant est porteur du variant GCK par stimulation insuffisante de son insulinosécrétion. En attendant la disponibilité en routine du dépistage prénatal non invasif, l’attitude thérapeutique reste discutée et l’insulinothérapie est guidée par la croissance échographique fœtale mesurée de façon séquentielle. L’autre élément singulier est que le génotype fœtal semble être le principal déterminant de la croissance fœtale et du risque de macrosomie indépendamment de l’insulinothérapie maternelle, et que les cibles glycémiques peuvent être difficiles à atteindre malgré une fréquence importante d’hypoglycémie maternelle. Ainsi, des études complémentaires sont nécessaires pour préciser la prise en charge des femmes GCK-MODY pendant la grossesse.
Abstract
GCK-MODY diabetes and pregnancy
GCK-MODY diabetes is characterized by moderate fasting hyperglycemia due to a variant in GCK encoding the glucokinase that controls the first step of insulin secretion in response to glucose. During pregnancy, there is a risk of macrosomia by stimulation of fetal insulin secretion in response to maternal hyperglycemia only when the child has not inherited the maternal variant (50% of cases). Thus, the treatment of maternal hyperglycemia is only necessary in this situation and could lead to a risk of growth retardation if the child harbours the GCK variant by insufficient stimulation of his insulin secretion. Pending the routine availability of non-invasive prenatal screening, the therapeutic approach remains controversial and insulin therapy is guided by sequential fetal ultrasound growth measured. It is important to note that the fetal genotype seems to be the main determinant of fetal growth and of the risk of macrosomia independently of maternal insulin therapy, and that glycemic targets may be difficult to reach with a high frequency of maternal hypoglycemia upon insulin therapy. Thus, additional studies are needed to clarify the management of GCK-MODY women during pregnancy.
Le diabète GCK-MODY (MODY2)
Caractéristiques du diabète MODY
Le diabète MODY (Maturity-Onset Diabetes of the Young) comprend un ensemble de formes monogéniques non auto-immunes de diabète, caractérisées par :
• une transmission autosomique dominante,
• un âge de survenue précoce (diagnostic souvent avant 40 ans)
• et l’absence initiale de dépendance à l’insuline.
Épidémiologie
La fréquence des diabètes MODY est de 1 à 2 % des diabètes chez l’adulte. Il existe une importante hétérogénéité puisque des variants d’au moins 17 gènes différents ont été décrits, tous conduisant à une dysfonction de l’insulinosécrétion. Les variants de GCK codant pour la glucokinase responsable du GCK-MODY (ou MODY2) sont l’une des causes les plus fréquentes de MODY (environ 30 % des diabètes MODY).
La glucokinase
Le diabète GCK-MODY est causé par une anomalie perte de fonction de la glucokinase. La glucokinase a une place majeure dans la régulation de la sécrétion d’insuline et joue le rôle de Glucose Sensor dans les cellules bêta pancréatiques (Fig. 1). Une glucokinase anormale conduit à déclencher la sécrétion d’insuline à un niveau de glycémie plus élevé. Plusieurs centaines de variants GCK ont été rapportées, avec un phénotype similaire chez la plupart des patients, dû à une compensation partielle de l’activité glucokinase par le second allèle non muté (mécanisme d’haploinsuffisance). La pénétrance est complète, tous les porteurs d’un variant GCK sont hyperglycémiques, depuis la naissance (1, 2).
Caractéristiques du diabète GCK-MODY
Chez les patients qui ont un GCK-MODY, le seuil de glucose pour la libération d’insuline est plus élevé que chez des individus sans variant GCK. Ainsi, le GCK-MODY est caractérisé par une hyperglycémie modérée à jeun, habituellement comprise entre 5,4 et 8,3 mmol/l, constante au cours de la vie et une HbA1c habituellement inférieure à 7 % (53 mmol/mol). Dans le foie, la glucokinase catalyse la première étape de la synthèse du glycogène, et les patients GCK-MODY présentent une diminution de la synthèse hépatique du glycogène et une augmentation relative de la néoglucogenèse, qui participent toutes deux à l’augmentation des taux de glucose post-prandiaux. Habituellement, l’augmentation de la glycémie 2 heures après une HGPO 75 g est inférieure à 3,0 mmol/l et presque toujours inférieure à 4,6 mmol/l. La glucokinase est aussi exprimée dans les cellules alpha pancréatiques et dans l’hypothalamus, et une contre-régulation à l’hypoglycémie se produit également à des taux de glycémie plus élevés chez les patients GCK-MODY.
Complications
Compte tenu du faible degré d’hyperglycémie, les patients avec un GCK-MODY sont asymptomatiques et, en l’absence d’autres facteurs de risque, les complications micro- et macrovasculaires sont rares, à l’exception d’une rétinopathie minime non cliniquement significative à long terme.
Prise en charge de l’hyperglycémie
Par conséquent, hors grossesse, aucun traitement de l’hyperglycémie n’est justifié chez les patients GCK-MODY. De plus, les traitements de l’hyperglycémie ne sont pas efficaces chez ces patients : dans des études observationnelles, les valeurs d’HbA1c étaient très similaires chez les patients traités et non traités et n’étaient pas affectées par l’arrêt du traitement. Il est probable que le seuil plus élevé de contre-régulation de l’hypoglycémie limite la normalisation des valeurs de glycémie par les traitements (1, 2).`
Le diabète GCK-MODY (MODY2) pendant la grossesse : une situation singulière
Prévalence et éléments d’orientation
La prévalence du diabète GCK-MODY au cours de la grossesse a récemment été estimée à 1/1 000 dans la population caucasienne, et à 1 % des patientes qui présentent un diabète gestationnel selon les critères de l’International Association of the Diabetes and Pregnancy Study Groups (IADPSG). Les éléments d’orientation vers un GCK-MODY comprennent :
• une glycémie à jeun pré-conceptionnelle ou au premier trimestre ≥ 5,5 mmol/l (99 mg/dl)
• et un IMC (indice de masse corporelle) avant la grossesse < 25 kg/m².
Dans ce cas, après avoir éliminé une auto-immunité, le génotypage à la recherche d’un GCK-MODY devrait être réalisé (3).
Les risques du diabète GCK-MODY pendant la grossesse
Fausses couches et malformations congénitales
Compte tenu des taux de glycémie et d’HbA1c observés chez les femmes GCK-MODY, on pourrait s’attendre à un taux de fausses couches et de malformations congénitales augmenté, mais peu d’études documentent ces issues de grossesse et ne sont pas concluantes.
Macrosomie
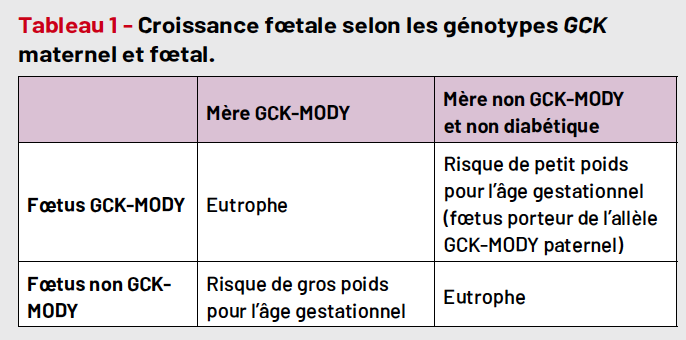
De même, par analogie à la relation entre les niveaux glycémiques et le risque d’avoir un enfant de gros poids pour l’âge gestationnel chez les femmes atteintes de diabète pré-gestationnel et gestationnel, il existe un risque d’excès de croissance lié à l’hyperinsulinisme fœtal en réponse à l’hyperglycémie maternelle chez les femmes GCK-MODY. Cependant, cette hypersécrétion d’insuline n’est possible que chez un fœtus dont la glucokinase est complètement fonctionnelle, donc pour un fœtus qui n’a pas hérité du variant maternel. Hattersley et al. ont montré que les enfants n’ayant pas hérité du variant GCK maternel avaient un poids de naissance supérieur de 600 g à celui des enfants ayant hérité du variant maternel. Cette observation a été confirmée par d’autres études (cf. infra) (4) (Tab. 1).
Conséquences de la macrosomie
La macrosomie peut être associée à une augmentation de l’incidence de la dystocie des épaules, asphyxie néonatale, déchirures périnéales, prématurité, césarienne, et hypoglycémie néonatale. Dans le contexte du diabète GCK-MODY, les taux de ces complications n’ont pas été systématiquement évalués. Certaines séries ont montré une incidence plus élevée de césarienne (5) et de dystocie des épaules (rapportée chez 4/15 bébés macrosomes dans la série de Spyer (6)).
Pas de conséquence métabolique à long terme pour les enfants
L’exposition fœtale au diabète maternel a été associée à des effets délétères à long terme, en particulier des anomalies de la sécrétion d’insuline et une hyperglycémie. Ceci a été montré chez les enfants de mères atteintes de diabète de type 2, mais aussi de diabète de type 1.
En ce qui concerne le diabète GCK-MODY, deux études n’ont démontré aucun effet évident à long terme chez les descendants.
• Dans la première, 42 adultes sans variant GCK nés de mères GCK-MODY ont été comparés à
39 individus nés de mères non diabétiques et sans variant GCK, à un âge médian de 42 et 36 ans, respectivement. Alors que les poids de naissance étaient plus élevés chez ces enfants nés de mères GCK-MODY (3 754 ± 544 g versus 3 391 ± 433 g), témoignant de l’exposition in utero à l’hyperglycémie maternelle, aucune différence n’a été observée dans les valeurs de glucose à jeun et après hyperglycémie provoquée par voie orale (75 g), les indices de sécrétion d’insuline et de sensibilité à l’insuline, l’IMC, la pression artérielle et les profils lipidiques entre les deux groupes.
• Dans la deuxième étude, 15 descendants non affectés de mères GCK-MODY ont été comparés à
14 descendants non affectés de pères GCK-MODY. Bien que les premiers pesaient en moyenne 720 g de plus à la naissance, ils ne présentaient aucune altération de la tolérance au glucose, de la sécrétion d’insuline, et aucune augmentation de l’IMC, du pourcentage de masse grasse corporelle et de la tension artérielle entre 36 et 39 ans (1).
Modalités de prise en charge des femmes avec un diabète GCK-MODY (MODY2) pendant la grossesse
L’insulinothérapie
En théorie, l’insulinothérapie devrait permettre de réduire le risque de macrosomie quand elle est utilisée chez les mères dont les enfants n’ont pas hérité du variant GCK maternel, et n’aurait pas d’indication pour les mères dont les enfants sont porteurs du variant GCK maternel. Cependant, il n’est actuellement pas possible de connaître en routine le génotype fœtal. En effet, le diagnostic anténatal sur ponction trophoblastique ou par amniocentèse n’est pas recommandé pour cette situation, compte tenu du risque de fausses couches lié à ces procédures en regard des enjeux du diabète pendant la grossesse, et les techniques de dépistage non invasif sur le sang maternel ne sont pas encore disponibles en routine.
Les stratégies médicales utilisées
Afin de réduire le risque de macrosomie chez les enfants de mères GCK-MODY, deux stratégies médicales sont utilisées en pratique courante :
• soit l’insulinothérapie est initiée dès le début de la grossesse selon les taux de glycémie maternels. Cette stratégie repose sur les recommandations habituelles pour la gestion du diabète pré-gestationnel ;
• soit l’insulinothérapie est débutée plus tard selon la croissance fœtale estimée par des mesures échographiques du périmètre abdominal (PA) répétées. Cette stratégie repose sur plusieurs essais randomisés contrôlés chez des femmes présentant un diabète gestationnel “commun” qui ont montré une réduction du taux de petits poids pour l’âge gestationnel dans le groupe des femmes traitées par insuline uniquement quand le PA dépassait le 75e percentile ou si les glycémies capillaires maternelles dépassaient des valeurs de sécurité (variables selon les études et au maximum > 6,7 mmol/l (120 mg/dl) pour la glycémie à jeun et > 11 mmol/l (200 mg/dl) pour la glycémie post-prandiale) par rapport aux femmes traitées conventionnellement.
Effet du traitement médical
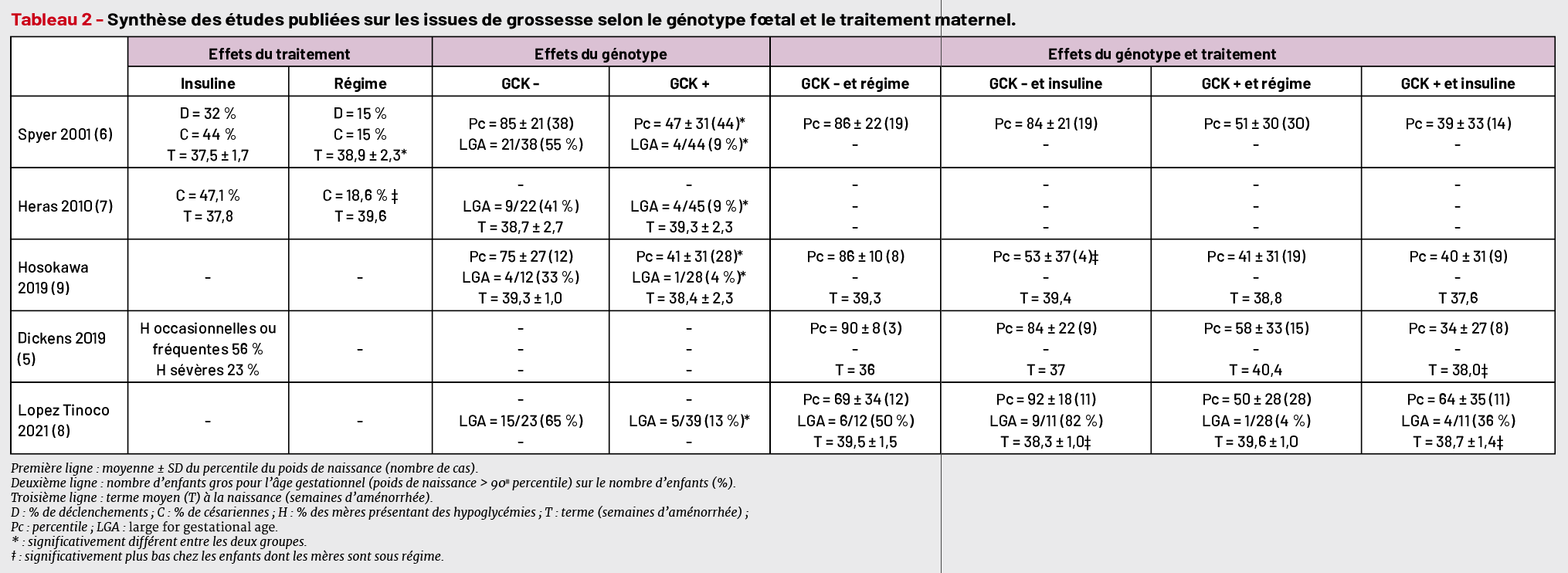
Cinq études observationnelles non randomisées se sont intéressées aux issues des grossesses selon le génotype fœtal et le type de traitement reçu par la mère dans le contexte du diabète GCK-MODY. Leurs résultats sont présentés dans le tableau 2 (5-9). En résumé, la croissance fœtale semble plus liée au génotype de l’enfant qu’au type de traitement pendant la grossesse. La fréquence élevée de la macrosomie chez les enfants non GCK-MODY malgré l’insulinothérapie maternelle suggère que les valeurs de glycémies optimales pour permettre une croissance fœtale normale n’étaient pas obtenues. Ceci pourrait être dû à un seuil plus élevé de contre-
régulation de l’hypoglycémie afin de maintenir une concentration de glucose plus élevée, comme en témoignent les doses parfois majeures d’insuline nécessaires pour normaliser les glycémies chez ces femmes.
D’autre part, l’insulinothérapie était associée à :
• une augmentation du taux de déclenchements et de césariennes (x 2 ou 3 dans certaines séries (6, 7)),
• un terme parfois plus précoce (6)
• et une fréquence élevée des hypoglycémies maternelles parfois sévères (jusqu’à 56 % des femmes traitées dont 23 % avec une hypoglycémie sévère dans une étude) (5).
Prise en charge en pratique
La gestion optimale du GCK-MODY reste discutée pendant la grossesse puisque la croissance fœtale est déterminée de façon prédominante par le génotype fœtal, et que celui-ci n’est pas connu en anténatal.
Estimation de la croissance fœtale
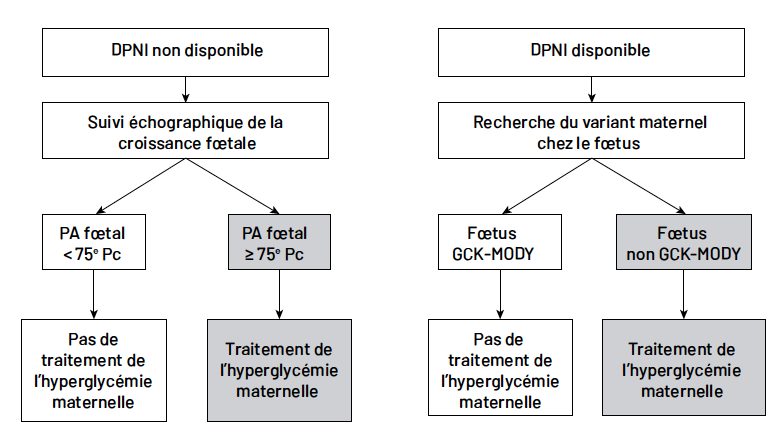
Une des pratiques possibles et favorisées par les experts anglo-saxons repose sur l’estimation de la croissance fœtale par la mesure du PA par échographies répétées à partir de 26 SA (10). Ainsi, si le PA dépasse le 75e percentile, l’hypothèse d’une hypersécrétion insulinique par un fœtus sans variant GCK en réponse à l’hyperglycémie maternelle peut être faite. Dans ce cas, l’insulinothérapie optimisée doit être considérée avec un déclenchement en cas de gros poids pour l’âge gestationnel, voire en systématique pour certaines équipes (Fig. 2).
Figure 2 – Physiopathologie du gène GCK impliqué dans le GCK-MODY (MODY2). DPNI : dépistage prénatal non invasif ; PA : périmètre abdominal.
Insulinothérapie d’emblée
D’autres considèrent que l’insulino-
thérapie est indiquée d’emblée sans tenir compte des données de la croissance fœtale compte tenu des imprécisions de l’échographie fœtale pour prédire le risque de macrosomie, de la variabilité intra- et inter-observateur de la mesure du PA, et de l’identification relativement tardive du risque de macrosomie, à un moment où l’intensification du traitement pourrait être moins efficace.
La consultation préconceptionnelle
Comme pour tout diabète prégestationnel, la patiente devrait être informée de la nécessité de préparer une future grossesse. La consultation pré-conceptionnelle permet :
• de discuter des objectifs glycémiques,
• des stratégies de traitement,
• d’interrompre les éventuels traitements antidiabétiques oraux utilisés hors grossesse (même s’ils sont habituellement inutiles),
• de prescrire de l’acide folique.
En pratique
D’un point de vue pragmatique, une HbA1c pré-conceptionnelle supérieure à 6,5 %, qui est le seuil habituellement visé pour limiter le risque de malformation congénitale grave, devrait faire considérer un traitement de l’hyperglycémie maternelle. En miroir, un ralentissement de la croissance fœtale < 10e percentile pourrait témoigner d’une insulinosécrétion fœtale trop faible et faire reconsidérer la poursuite de l’insulinothérapie maternelle si celle-ci avait été introduite.
Un suivi spécialisé conjoint
Un suivi spécialisé conjoint par un(e) diabétologue ou endocrinologue d’une part, et un(e) obstétricien(ne) habitué(e) à ces situations dans une maternité avec une unité de néonatologie, donc au moins une maternité de type 2, paraît raisonnable. En cas d’insulino-
thérapie, une vigilance doit être portée sur la survenue d’hypoglycémies maternelles qui peuvent faire reconsidérer les valeurs des cibles glycémiques.
La disponibilité à venir du dépistage prénatal non invasif du génotype GCK sur plasma maternel, réalisable dès 10-14 SA, devrait permettre d’optimiser le choix de traitement (Fig. 2) (11).
À suivre
Un PNDS (protocole national de soins) sur la prise en charge des diabètes monogéniques y compris pendant la grossesse est en cours de rédaction. Les données observationnelles d’un PHRC portant sur les deux stratégies de traitement (insuline d’emblée ou guidée par l’appréciation de la croissance fœtale échographique) seront bientôt disponibles. L’analyse de ces résultats, bien que reposant sur une stratégie de traitement non randomisée, pourrait permettre de savoir si une stratégie est plus pertinente qu’une autre.
À RETENIR
• La grossesse est une situation qui doit faire rechercher un GCK-MODY notamment quand la glycémie à jeun dépasse 5,5 mmol/l et que l’IMC maternel est inférieur à 25 kg/m², après avoir éliminé une auto-immunité.
• Le risque de macrosomie (et ses complications) est l’enjeu principal des grossesses chez les femmes GCK-MODY et dépend principalement du génotype de l’enfant.
• La stratégie de prise en charge n’est pas complètement codifiée et repose sur l’appréciation séquentielle de la croissance fœtale échographique.
• L’accessibilité du dépistage prénatal non invasif (DPNI) pourrait prochainement changer l’approche thérapeutique de ces grossesses.
Les auteurs déclarent ne pas avoir de liens d’intérêt en relation avec cet article.
Bibliographie
1. Timsit J, Ciangura C, Dubois-Laforgue D et al. Pregnancy in women with monogenic diabetes due to pathogenic variants of the glucokinase gene: lessons and challenges. Front Endocrinol 2022 ;12 : 802423.
2. Chung WK, Erion K, Florez JC et al. Precision medicine in diabetes: a consensus report from the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2020 ; 63: 1671-93.
3. Rudland VL, Hinchcliffe M, Pinner J et al. Identifying glucokinase monogenic diabetes in a multiethnic gestational diabetes mellitus cohort: new pregnancy screening criteria and utility of HbA1c. Diabetes Care 2016 ; 39 : 50-2.
4. Hattersley AT, Beards F, Ballantyne E et al. Mutations in the glucokinase gene of the fetus result in reduced birth weight. Nat Genet 1998 ; 19 : 268-70.
5. Dickens LT, Letourneau LR, Sanyoura M et al. Management and pregnancy outcomes of women with GCK-MODY enrolled in the US Monogenic Diabetes Registry. Acta Diabetol 2019 ; 56 : 405-11.
6. Spyer G, Hattersley AT, Sykes JE et al. Influence of maternal and fetal glucokinase mutations in gestational diabetes. Am J Obstet Gynecol 2001 ; 185 : 240-1.
7. de Las Heras J, Martínez R, Rica I et al. Heterozygous glucokinase mutations and birth weight in Spanish children. Diabet Med 2010 ; 27 : 608-10.
8. López Tinoco C, Sánchez Lechuga B, Bacon S et al. Evaluation of pregnancy outcomes in women with GCK-MODY. Diabet Med 2021 ; 38 : e14488.
9. Hosokawa Y, Higuchi S, Kawakita R et al. Pregnancy outcome of Japanese patients with glucokinase-maturity-onset diabetes of the young. J Diabetes Investig 2019 ; 10 : 1586-9.
10. Rudland VL. Diagnosis and management of glucokinase monogenic diabetes in pregnancy: current perspectives. Diabetes Metab Syndr Obes 2019 ; 12 :1081-9.
11. Kwak SH, Powe CE, Jang SS et al. Sequencing cell-free fetal DNA in pregnant women with GCK-MODY. J Clin Endocrinol Metab 2021 ; 106 : 2678-89.