Résumé
Nous connaissons les agonistes du récepteur du GLP‑1 (aGLP‑1R) comme antidiabétiques et comme médicaments contre l’obésité. Mais leur potentiel pourrait aller bien au-delà. De nombreuses études montrent que ces molécules pourraient aussi agir là où on les attendait le moins, sur le terrain de l’addiction. Chez les rongeurs comme chez les primates, les aGLP‑1R ont démontré leur capacité à réduire l’attrait pour l’alcool, la nicotine, mais aussi pour des drogues dures telles que la cocaïne, les amphétamines ou les opioïdes. Aujourd’hui, un essai clinique de phase II, mené entre les États-Unis et le Canada, vient renforcer cet espoir. Des patients souffrant de dépendance à l’alcool ont reçu pendant 9 semaines une dose hebdomadaire de sémaglutide, le principe actif derrière l’Ozempic® et Wegovy®. Le résultat est impressionnant : il montre une chute significative de la consommation d’alcool et de leur niveau de dépendance. Cette avancée marque un tournant prometteur dans la quête de traitements plus sûrs et mieux tolérés que les thérapies classiques comme la méthadone ou la buprénorphine.
Abstract
From diabetes to addiction: the new promises of GLP‑1 receptor agonists
We know GLP‑1 receptor agonists (GLP‑1RAs) as antidiabetic drugs and as treatments for obesity. But their potential might go far beyond that metabolic applications! An increasing number of studies suggest these molecules could also be effective where we least expected it — in the complex world of addiction. In both rodents and primates, GLP‑1RAs have shown the ability to reduce the appeal of alcohol, nicotine, and even hard drugs like cocaine, amphetamines, and opioids. At the present time, a phase 2 clinical trial conducted across the United States and Canada is strengthening this hope. Patients with alcohol dependence were given over a nine-week period, a low weekly dose of semaglutide the active ingredient in the well-known drugs Ozempic® and Wegovy®. The result showed a significant drop in both alcohol consumption and dependency levels. This breakthrough provides a promising turning point in the search for safer, better-tolerated alternatives to traditional treatments like methadone or buprenorphine.
Introduction
Il y a à peine 20 ans, l’exénatide (Byetta®), premier représentant d’une toute nouvelle classe thérapeutique des agonistes du récepteur du GLP‑1 (aGLP‑1R), recevait le feu vert de l’agence américaine du médicament, une petite révolution qui voyait le jour dans le monde des antidiabétiques. Commercialisé par Eli Lilly, l’exénatide ouvrait ensuite la voie à une série de molécules prometteuses. En 2009, c’est Novo Nordisk qui entre en scène avec le liraglutide (Victoza®). Puis vinrent le dulaglutide (Trulicity®), le sémaglutide (Ozempic®), sa version orale (Rybelsus®), ou encore le lixisénatide (Lyxumia®).
Dans le traitement du diabète de type 2
Tous ont l’objectif commun de traiter le diabète de type 2 (DT2) avec une efficacité inédite et un atout principal, leur finesse d’action. Contrairement aux sulfonylurées et les glinides, les aGLP‑1R stimulent la sécrétion d’insuline uniquement en réponse à une prise alimentaire, évitant ainsi les hypoglycémies. Ils semblent aussi préserver l’intégrité des îlots pancréatiques, en protégeant les cellules bêta de la mort provoquée par des toxiques cellulaires comme l’inflammation, l’hyperlipidémie et l’hyperglycémie chronique.
Dans la perte de poids
Très vite, un autre avantage fait parler d’eux : la perte de poids. Grâce à un ralentissement de la vidange gastrique et une action directe sur l’hypothalamus, le centre de la satiété, ces médicaments coupent la faim. Moins de fringales, moins d’apports caloriques : le corps s’allège. C’est dans ce contexte qu’apparaissent, avec un succès remarquable, le liraglutide (Saxenda®), le sémaglutide (Wegovy®) et la tirzépatide (Mounjaro®), des médicaments réservés au traitement de l’obésité, même sans diabète. En 2023 et en 2024, ce sont respectivement près de 550 000 et 700 000 personnes qui ont reçus l’Ozempic® en France. Une vague qui ne cesse de monter. Et ce n’est peut-être qu’un début.
Les aGLP‑1R, initialement conçus pour le diabète, puis détournés pour l’obésité, pourraient bien trouver une troisième vocation : le traitement de l’addiction. Une étude interventionnelle récente menée sur 48 patients non diabétiques souffrant de troubles liés à l’alcool a montré qu’une simple injection hebdomadaire de sémaglutide, à faible dose, pendant 9 semaines, réduit de manière significative la consommation d’alcool, le craving hebdomadaire (1)… mais aussi le nombre de cigarettes fumées. Alors, les aGLP‑1R, futurs médicaments anti-dépendance ? Une nouvelle facette de ces molécules caméléons pourrait bien s’ajouter à leur incroyable success-story.
Un même médicament contre le diabète et l’obésité, la fabuleuse histoire des aGLP‑1R
L’exénatide
Tout a commencé en 2005, avec l’arrivée de l’exénatide sur le marché (2). Ce médicament révolutionnaire doit son existence à une découverte pour le moins exotique : l’exendine-4, un peptide quasi jumeau du GLP‑1, isolé dans les années 1990 dans le venin du monstre de Gila (3). Ce peptide reptilien, bien plus stable que le GLP‑1 humain (2 heures contre 3 à 5 minutes), stimule le même récepteur et mime ainsi les effets de l’hormone intestinale. Son “humanisation” a donné naissance au tout premier analogue injectable des aGLP‑1R.
Le liraglutide
Quatre ans plus tard, Novo Nordisk change la donne avec le liraglutide, un aGLP‑1R plus proche du GLP‑1 humain et surtout bien plus pratique : une injection quotidienne, contre deux pour l’exénatide. Avec une meilleure adhésion des patients, et des effets significatifs sur le poids, le liraglutide et les autres aGLP‑1R qui suivront mettront progressivement à l’écart l’exénatide. Ce dernier, pionnier un temps, cédera peu à peu la scène à une génération de molécules plus performantes, plus confortables… et bien plus ambitieuses.
Car, aujourd’hui, les aGLP‑1R ne se contentent plus de traiter le diabète : ils redessinent les contours de la pharmacothérapie. Leur percée dans la lutte contre l’obésité, même en l’absence de diabète, leur effet cardioprotecteur, et le succès fulgurant de molécules comme le liraglutide (Saxenda®), le sémaglutide (Wegovy®) ou encore le tirzépatide (Mounjaro®), marquent un tournant décisif. Un même médicament, plusieurs cibles thérapeutiques : voilà toute la puissance de ces agents nouvelle génération. Leur polyvalence s’explique par leur capacité à imiter le GLP‑1, une hormone multifonction aux récepteurs présents, non seulement dans le pancréas, mais aussi dans le cœur, le cerveau et le système digestif (Fig. 1).
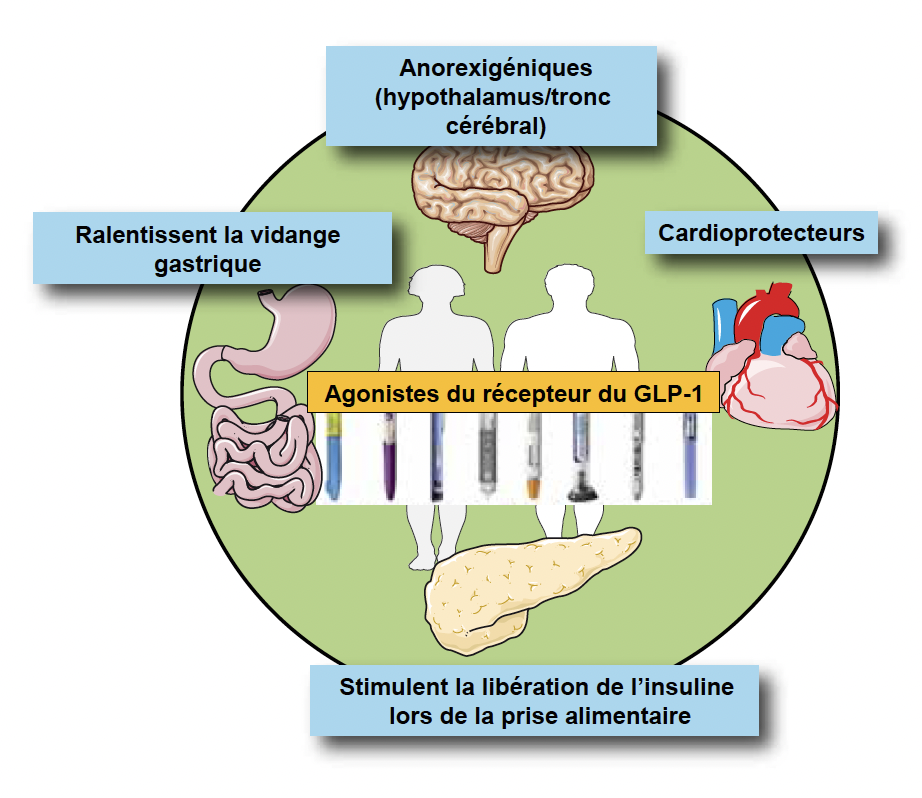
Figure 1 – Polyvalence reconnue des aGLP‑1R.
Les aGLP‑1R ont des effets bénéfiques pléiotropes. Ils stimulent la sécrétion de l’insuline uniquement lors d’un repas et évitent ainsi le risque d’hypoglycémie. Ils coupent l’appétit, tout en aidant à mieux manger, en stimulant un signal cérébral satiétogène et en ralentissant la vidange gastrique, un atout de taille dans la lutte contre l’obésité. Ils sont aussi cardioprotecteurs.
L’alcoolisme, la nouvelle cible des aGLP‑1R
La découverte de récepteurs GLP‑1 (GLP‑1R) au cœur du système de récompense a ouvert un champ de recherche totalement inattendu. En effet, c’est en partant de cette simple observation que les premières études sur le lien entre GLP‑1 et addiction ont vu le jour.
Principe
Dans le cerveau, les neurones dopaminergiques de l’aire tegmentale ventrale (ATV) et du noyau accumbens (NA), les grands chefs d’orchestre du plaisir, du conditionnement et de la motivation, sont tous équipés de ces fameux récepteurs GLP‑1R. Ce sont précisément ces neurones qui sont activés par les substances procurant du plaisir, comme l’alcool, le tabac ou les opioïdes. Leur rôle dans la dépendance est donc central. Alors, une hypothèse audacieuse a émergé (Fig. 2) : si les aGLP‑1R sont capables d’agir sur l’hypothalamus pour réguler la satiété et faire fondre les kilos, pourquoi ne pourraient-ils pas aussi freiner les comportements hédoniques, et briser le cycle de l’addiction, notamment à l’alcool ? Rappelons que l’alcool est la deuxième substance psychoactive la plus consommée en France, juste après le tabac. Près de 24 % des adultes dépassent les seuils de consommation à moindre risque. Autrement dit, le besoin d’outils thérapeutiques efficaces est immense.
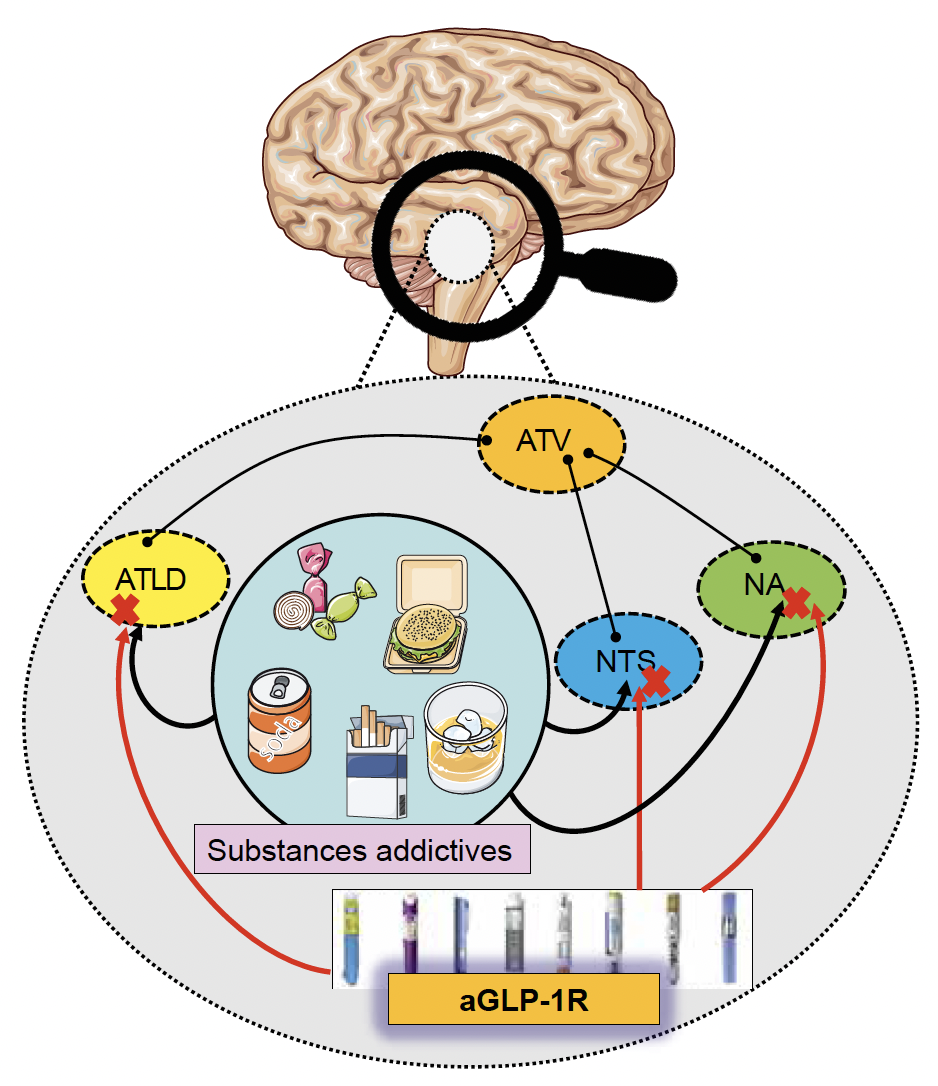
Figure 2 – Effet des aGLP‑1R sur le mécanisme de l’addiction.
Certaines zones de la récompense (le noyau du tractus solitaire/NTS, le noyau accumbens/NA, l’aire tegmentale ventrale/ATV, l’aire tegmentale latérodorsale/ATLD) sont les cibles des aGLP‑1R (flèches rouges). Suite à la consommation de substances addictives (l’alcool, une drogue ou des aliments sucrés et/ou gras), les neurones de l’ATV, du NA, et aussi dans une moindre mesure ceux du NTS, libèrent de la dopamine. Cette libération permet de mémoriser le stimulus agréable procurant du plaisir, conditionnant ainsi la consommation récurrente des substances et des aliments, créant alors une dépendance physique et psychologique après la consommation répétée de ces substances. Les aGLP‑1R antagoniseraient l’effet des substances addictives sur ces neurones.
Résultats
Cette idée, autrefois marginale, est aujourd’hui soutenue par des données précliniques. Et les résultats sont plutôt prometteurs (Fig. 3).
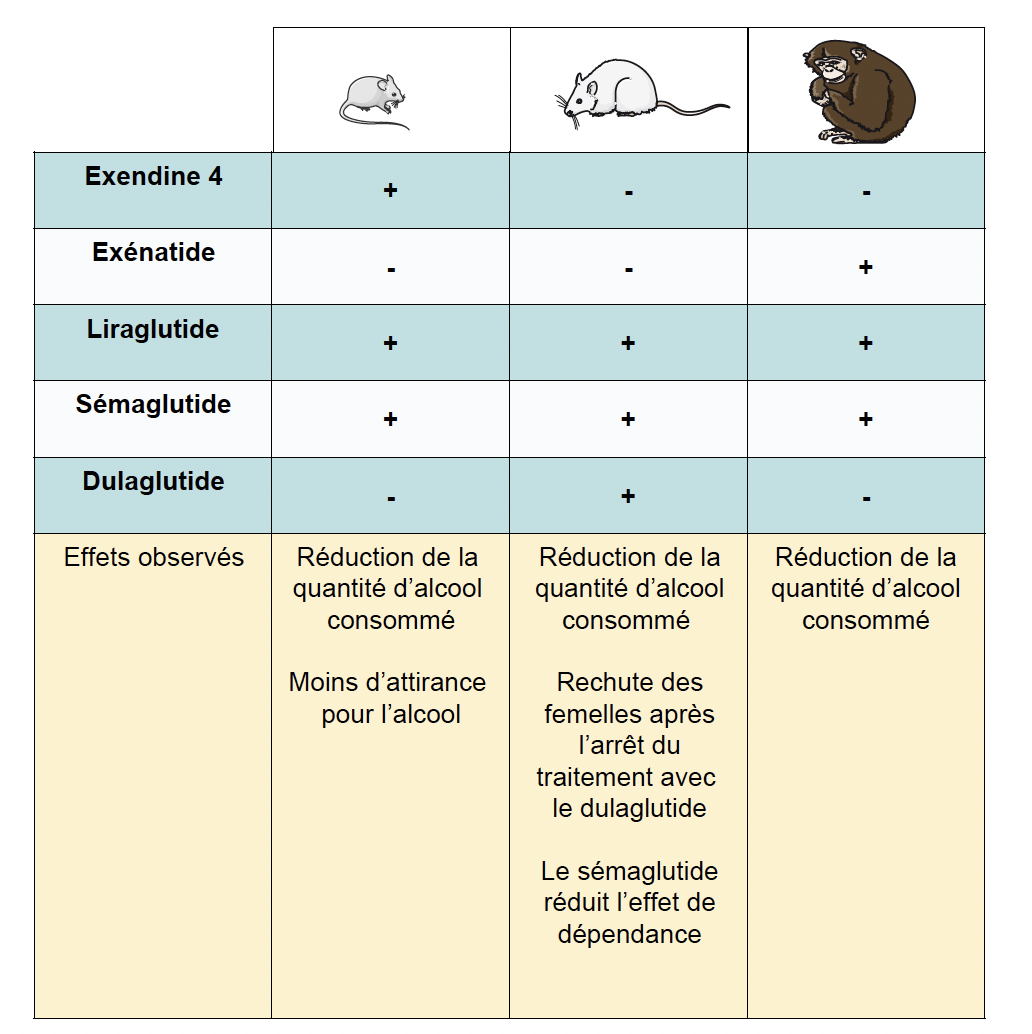
Figure 3 – Les aGLP‑1R testés sur l’addiction à l’alcool dans les modèles animaux. Certains aGLP‑1R ont été testés (+) ou pas (-) chez la souris, le rat et le singe.
Un effet anti-addiction
Chez la souris et le singe, les aGLP‑1R montrent un effet net sur la réduction de la consommation d’alcool (4-6).
• Dans des modèles expérimentaux où les animaux peuvent librement choisir entre de l’eau et une solution alcoolisée, les observations sont frappantes : le liraglutide diminue l’attrait des souris pour l’alcool et freine la libération de dopamine dans le NA.
• Le sémaglutide réduit la consommation excessive d’alcool de manière dose-dépendante, chez les souris comme chez les rats, mâles et femelles (7, 8). Ce médicament traverse la barrière hémato-encéphalique et est détecté dans le NA des rats buveurs, preuve qu’il agit directement au cœur du système de récompense. Cet effet anti-addiction n’est pas réservé au liraglutide et au sémaglutide.
• Le dulaglutide montre aussi des effets similaires chez les rongeurs.
Un effet sexe dépendant
Autre observation marquante, qui ressort de cette étude réalisée avec le dulaglutide, est que l’effet anti-addiction des aGLP‑1R varie selon le sexe. C’est particulièrement le cas pour le dulaglutide. Ce dernier réduit la consommation d’alcool chez les rats mâles et femelles lorsque les animaux sont traités pendant 5 semaines (9). Cependant, seules les femelles rechutent après le traitement (9). Cette observation peut faire penser à un effet dépendant du sexe. Chez l’Homme, il existe déjà un dimorphisme sexuel sur l’effet des aGLP‑1R. La perte de poids est notable chez les femmes, tandis que les hommes bénéficient d’une meilleure réponse glycémique (10, 11). Les signatures épigénétiques et génétiques, combinées à des variations de l’absorption et de biodistribution des aGLP‑1R liées au sexe, pourraient peut-être influencer l’effet des aGLP‑1R, y compris sur l’alcool.
L’effet du sémaglutide sur la consommation d’alcool… et le tabac, confirmé par une étude prospective interventionnelle
Chez l’Homme, les premiers indices d’un effet anti-alcool des aGLP‑1R sont venus des études observationnelles (12, 13).
• L’une des plus marquantes est une étude danoise rétrospective de grande ampleur, menée entre 2009 et 2017, qui a croisé les données de plus de 38 000 utilisateurs d’aGLP‑1R avec celles de 49 000 sous inhibiteurs de la DPP-4 (13). Dès les 3 premiers mois de traitement, une baisse nette du risque d’événements liés à l’alcool a été observée chez les patients traités par aGLP‑1R avec moins d’hospitalisations pour troubles liés à l’alcool et moins de prescriptions de traitements de sevrage. Une association intrigante, mais non causale… jusqu’à ce qu’un essai clinique américain vienne conforter l’hypothèse (1).
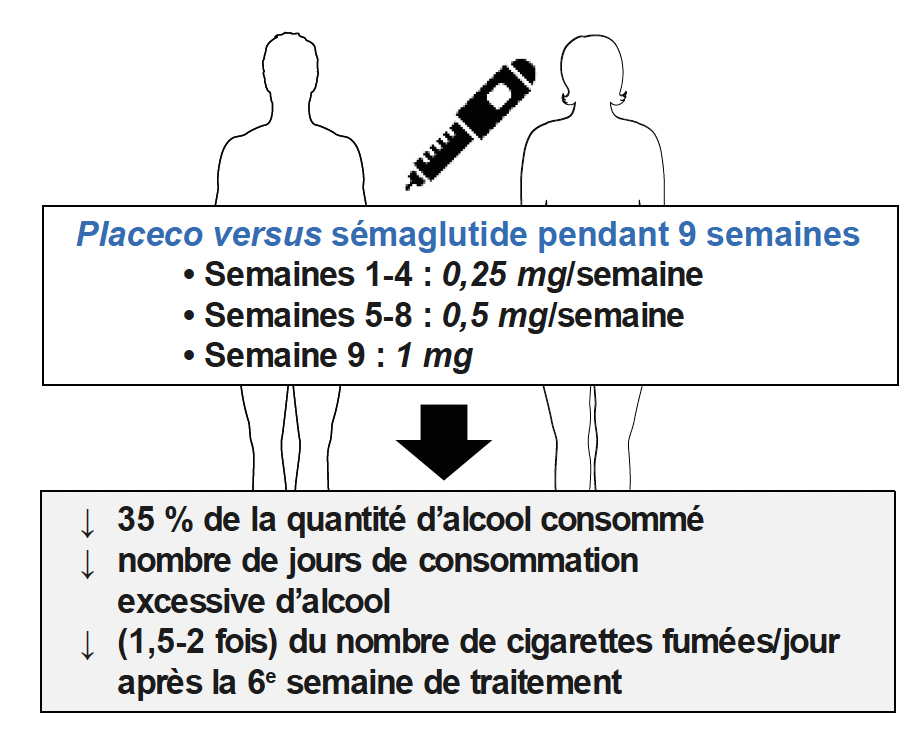
• Menée aux États-Unis et au Canada sur 48 adultes non diabétiques souffrant d’un trouble de l’usage de l’alcool, cette étude a testé le sémaglutide à faible dose, injecté une fois par semaine pendant 9 semaines. Il a été observé une chute marquée de la consommation d’alcool, une diminution des envies de boire et, chez les fumeurs, une réduction significative du nombre de cigarettes quotidiennes (Fig. 4).
Figure 4 – Étude prospective du sémaglutide (Ozempic®) versus placebo sur l’addiction à l’alcool chez l’Homme.
Au total, 48 individus (14 hommes et 34 femmes, avec une moyenne d’âge ~ 40 ans et d’IMC ~ 30 kg/m²) ont reçu soit un placebo, soit du sémaglutide avec une dose variable toutes les 4 semaines.
Vers une action anti-addiction plus globale des aGLP‑1R ?
Au-delà de l’alcool et du tabac, les aGLP‑1R, tels que le sémaglutide, pourraient bien devenir de véritables armes polyvalentes contre d’autres addictions comme les opioïdes, la nicotine, le cannabis.
Les études précliniques
Une série d’études précliniques soutient cette hypothèse (14-16).
• Chez le rat, l’exendine-4 et le liraglutide réduisent la recherche compulsive d’héroïne, freinent l’auto-administration de fentanyl et d’oxycodone, et préviennent la rechute déclenchée par le stress ou la drogue. Ces effets semblent liés à une modulation des circuits de récompense, notamment via les récepteurs du GLP‑1 dans le noyau accumbens (NA) et l’activation du système orexinergique.
• Côté nicotine, les résultats sont tout aussi prometteurs : les aGLP‑1R atténuent la libération de dopamine induite par la nicotine, réduisent la consommation active, accélèrent l’extinction comportementale et préviennent la prise alimentaire compensatoire au sevrage.
Les approches d’imagerie cérébrale et de neurophysiologie
Des résultats renforcés par des approches d’imagerie cérébrale et de neurophysiologie confirment l’effet direct des aGLP‑1R sur les réseaux impliqués dans la récompense, l’impulsivité et la motivation.
Chez l’Homme
Si les données précliniques sont abondantes, les preuves humaines restent manquantes. Quelques études observationnelles commencent néanmoins à faire émerger des signaux intéressants.
• Des analyses de bases de données rétrospectives américaines ont mis en évidence une baisse de l’overdose aux opioïdes chez des patients diabétiques traités par aGLP‑1R (17).
• Pour le cannabis, les données humaines restent quasi inexistantes, bien que certaines études d’imagerie cérébrale sous aGLP‑1R aient montré une modulation de régions cérébrales impliquées dans le craving généralisé.
Ces résultats préliminaires ouvrent la voie à de futurs essais cliniques, indispensables pour confirmer l’éventuelle action trans-addictive des aGLP‑1R.
Conclusion
Les traitements actuels contre l’addiction existent, mais sont loin d’être parfaits. Chaque molécule cible une dépendance spécifique, avec des résultats parfois mitigés.
• La naltrexone, par exemple, réduit le plaisir lié à l’alcool ou aux opioïdes, mais s’accompagne souvent de nausées, de fatigue, voire de troubles hépatiques.
• La méthadone et la buprénorphine, bien qu’efficaces lors du sevrage, peuvent elles-mêmes devenir sources de dépendance.
• Pour le tabac, les substituts nicotiniques ou la varénicline (Champix®) sont courants, mais provoquent des effets secondaires comme des troubles du sommeil et psychiatriques, compliquant ainsi leur utilisation.
• Quant à la cocaïne, l’arsenal pharmacologique est encore balbutiant, reposant sur des approches expérimentales.
Dans ce paysage encore imparfait, les aGLP‑1R ont donc leur carte à jouer. Leur faible risque d’abus, leur bonne tolérance et leur action indirecte, mais puissante, sur les circuits cérébraux de la récompense font qu’ils pourraient bien révolutionner le traitement des addictions. Contrairement aux traitements classiques, ils ne devraient induire ni euphorie ni dépendance, et pourraient même freiner l’envie, et aussi prévenir les rechutes. En plus, déjà plébiscité pour le diabète et l’obésité, leur usage est déjà bien intégré dans les pratiques cliniques, ce qui promet une meilleure observance. Si les essais cliniques confirment leur potentiel, les aGLP‑1R pourraient offrir une nouvelle génération de thérapies anti-addiction, plus sûres, plus globales, enfin à la hauteur des enjeux.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Hendershot CS, Bremmer MP, Paladino MB et al. Once-weekly semaglutide in adults with alcohol use disorder. JAMA Psychiatry 2025 ; 82 : 395‑405.
2. Baggio LL, Drucker DJ. Glucagon-like peptide-1 receptor co-agonists for treating metabolic disease. Mol Metab 2021 ; 46 : 101090.
3. Göke R, Fehmann HC, Linn T et al. Exendin-4 is a high potency agonist and truncated exendin-(9-39)-amide an antagonist at the glucagon-like peptide 1-(7-36)-amide receptor of insulin-secreting beta-cells. J Biol Chem 1993 ; 268 : 19650‑5.
4. Liu W, Wang Z, Wang W et al. Liraglutide reduces alcohol consumption, anxiety, memory impairment, and synapse loss in alcohol dependent mice. Neurochem Res 2024 ; 49 : 1061‑75.
5. Thomsen M, Holst JJ, Molander A et al. Effects of glucagon-like peptide 1 analogs on alcohol intake in alcohol-preferring vervet monkeys. Psychopharmacology 2019 ; 236 : 603‑11.
6. Fink-Jensen A, Wörtwein G, Klausen MK et al. Effect of the glucagon-like peptide-1 (GLP‑1) receptor agonist semaglutide on alcohol consumption in alcohol-preferring male vervet monkeys. Psychopharmacology 2025 ; 242 : 63‑70.
7. Chuong V, Farokhnia M, Khom S et al. The glucagon-like peptide-1 (GLP‑1) analogue semaglutide reduces alcohol drinking and modulates central GABA neurotransmission. JCI Insight 2023 ; 8 : e170671.
8. Aranäs C, Edvardsson CE, Shevchouk OT et al. Semaglutide reduces alcohol intake and relapse-like drinking in male and female rats. eBioMedicine 2023 ; 93 : 104642.
9. Vallöf D, Kalafateli AL, Jerlhag E. Long-term treatment with a glucagon-like peptide-1 receptor agonist reduces ethanol intake in male and female rats. Transl Psychiatry 2020 ; 10 : 1‑12.
10. Anichini R, Cosimi S, Di Carlo A et al. Gender difference in response predictors after 1-year exenatide therapy twice daily in type 2 diabetic patients: a real world experience. Diabetes Metab Syndr Obes Targets Ther 2013 ; 6 : 123‑9.
11. Yang Y, He L, Han S et al. Sex differences in the efficacy of glucagon-like peptide-1 receptor agonists for weight reduction: a systematic review and meta-analysis. J Diabetes 2025 ; 17 : e70063.
12. Subhani M, Dhanda A, King JA et al. Association between glucagon-like peptide-1 receptor agonists use and change in alcohol consumption: a systematic review. eClinicalMedicine 2024 ; 78 : 102920.
13. Wium-Andersen IK, Wium-Andersen MK, Fink-Jensen A et al. Use of GLP‑1 receptor agonists and subsequent risk of alcohol-related events. A nationwide register-based cohort and self-controlled case series study. Basic Clin Pharmacol Toxicol 2022 ; 131 : 372‑9.
14. Sørensen G, Reddy IA, Weikop P et al. The glucagon-like peptide 1 (GLP‑1) receptor agonist exendin-4 reduces cocaine self-administration in mice. Physiol Behav 2015 ; 149 : 262‑8.
15. Hernandez NS, Weir VR, Ragnini K et al. GLP‑1 receptor signaling in the laterodorsal tegmental nucleus attenuates cocaine seeking by activating GABAergic circuits that project to the VTA. Mol Psychiatry 2021 ; 26 : 4394‑408.
16. Chaves Filho AJM, Cunha NL, de Souza AG et al. The GLP‑1 receptor agonist liraglutide reverses mania-like alterations and memory deficits induced by D-amphetamine and augments lithium effects in mice: Relevance for bipolar disorder. Prog Neuropsychopharmacol Biol Psychiatry 2020 ; 99 : 109872.
17. Qeadan F, McCunn A, Tingey B. The association between glucose-dependent insulinotropic polypeptide and/or glucagon-like peptide-1 receptor agonist prescriptions and substance-related outcomes in patients with opioid and alcohol use disorders: A real-world data analysis. Addiction 2025 ; 120 : 236‑50.