L’essentiel en un clin d’œil
• Effets de l’intensité de l’exercice sur la sensibilité à l’insuline et la composition lipidique du muscle squelettique.
• Sensibilité à l’insuline et modalités d’exercice.
• Effets des collations sur les paramètres cardio-métaboliques de jeunes adultes en surpoids ou obèses.
• Piezo1 des myofibres régule l’hypertrophie musculaire et le métabolisme en réponse à l’exercice.
• Analyse du méthylome et du transcriptome du muscle squelettique après exercice chez des femmes diabétiques de type 2 comparées à des femmes à la tolérance glycémique normale.
TOP 5 – Effets de l’intensité de l’exercice sur la sensibilité à l’insuline et la composition lipidique du muscle squelettique
Les lipides intramyocellulaires (IMCL), modifiés par l’exercice physique, ont un effet sur la sensibilité à l’insuline du muscle squelettique. La relation entre les changements de composition des IMCL dus à l’intensité de l’exercice et la sensibilité à l’insuline ainsi que les mécanismes moléculaires sous-jacents ne sont toutefois pas entièrement compris. Cette étude de l’université de Tokyo mesure l’effet de l’exercice sur la composition lipidique du muscle squelettique et sur la potentielle amélioration de la sensibilité à l’insuline.
Une étude japonaise
Ont ainsi été recrutés 20 hommes de 20 à 50 ans présentant une résistance modérée à l’insuline (HOMA-IR ≥ 1,6) et au moins un facteur de risque cardiovasculaire (TG > 150 mgdl ou HDL< 40 mg/dl ou TA > 130 mmHg de maxima ou TA > 85 mmHg de minima ou glycémie à jeun > 110 mg/dl).
Ces sujets ont été assignés à un groupe d’exercices de faible intensité (LIE) (pic de VO2 à 40 %, n = 11) ou d’exercices de haute intensité (VIE) (pic de VO2 à 70 %, n = 9), pendant 5 jours en ciblant 300 kcal/jour de dépense énergétique.
La résistance à l’insuline a été évaluée par clamps euglycémiques hyperinsulinémiques et les niveaux d’IMCL dans le muscle tibial antérieur (TA-IMCL) ont été mesurés avant et après le programme d’exercice. Les biopsies musculaires ont été analysées par chromatographie liquide couplée à la spectrométrie de masse pour la lipidomique et par l’ARNseq pour l’expression des gènes du muscle squelettique.
Les résultats
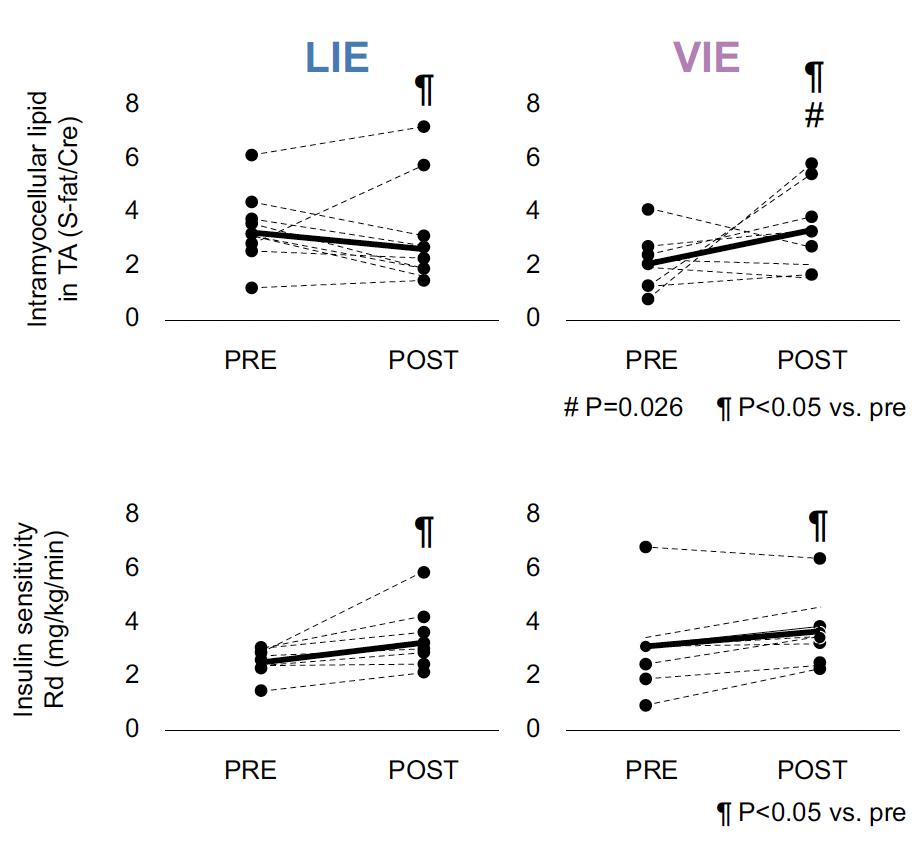
L’exercice a induit des changements significatifs dans les niveaux de TA-IMCL entre les groupes LIE (-21 %) et HIE (+55,0 %), mais les deux intensités d’exercice ont augmenté de manière similaire la sensibilité à l’insuline (Fig. 1).
Figure 1 – Amélioration par l’exercice de basse ou de haute intensité de la sensibilité à l’insuline et modification de la composition lipidique musculaire.
S’agissant des lipides du muscle squelettique, ce sont les phospholipides qui ont été modifiés avec l’intensité de l’exercice, plus précisément, l’acide lysophosphatidique (22:6), la phosphatidylcholine (40:6) et la phosphatidylsérine (40:6), y compris l’acide docosahexaénoïque (22:6), ainsi que certains phosphatidylinositol et cardiolipine augmentés dans le groupe VIE. De nombreux lysophospholipides ont aussi augmenté dans le groupe LIE.
Lors des changements de la composition lipidique, l’expression de la phospholipase A2 groupe IV (PLA2G4), impliquée dans la production de lysophospholipides dans LIE, de l’ELOVL Fatty Acid Elongase 2 (ELOVL2) et de la Fatty Acid Desaturase 1 (FADS1), impliquées dans la biosynthèse de l’acide docosahexaénoïque dans HIE, a été modifiée.
À retenir
L’intensité de l’exercice contribue à l’amélioration de la sensibilité à l’insuline dans le muscle squelettique par la régulation de différentes compositions lipidiques.
• Kakehi S, Watada H, Kawamori R et al. Effects of exercise intensity on the insulin sensitivity and lipid composition in skeletal muscle under the same calorie consumption exercise. EASD 2024 : #133.
TOP 4 – Sensibilité à l’insuline et modalités d’exercice
La sensibilité à l’insuline est améliorée dans les heures et les jours suivant un exercice. Mais la plupart des observations reposent sur des clamps et aucune étude n’a examiné l’évolution dans le temps de l’élimination du glucose après une seule séance d’exercice d’intensité variable, en utilisant un test où les mécanismes homéostatiques du glucose restent intacts, comme l’HGPO.
Cette présentation danoise a suivi la sensibilité à l’insuline dans les jours suivant une séance d’exercice et a évalué la variabilité inter et intra-individuelle de celle-ci.
Une étude danoise randomisée
Ont été recrutés pour une étude randomisée en cross-over 24 participants (58 % de femmes), d’âge moyen de 54 ans, d’IMC de 32 kg/m² et physiquement inactifs (c’est-à-dire moins de 1,5 heure d’exercice par semaine). La sensibilité médiane à l’insuline de base (Q1-Q3) était de 3,3 unités arbitraires (UA).
Les sujets ont subi trois séries de tests de 50 minutes dans un ordre aléatoire :
• exercice aérobique continu (64-76 % de la fréquence cardiaque maximale (Fcmax)) ;
• exercice par intervalles à haute intensité (HIIT ; 5 x 4 min à > 85 % de la FCmax) ;
• exercice de force (trois séries de 10 répétitions à 70 % du maximum de quatre exercices antérieurs).
Avant les épreuves, les sujets ont bénéficié d’une mesure de la VO2 max et d’une HGPO (baseline) puis chaque séance était suivie d’une HGPO à 24 et 48 heures de l’exercice.
Avec une semaine de washout entre chaque séance, permettant à tous de pratiquer les trois types d’exercice successivement, l’étude a duré 7 semaines. Le principal résultat était le changement de l’indice de Matsuda, dont l’augmentation indique une plus grande sensibilité à l’insuline.
Les résultats
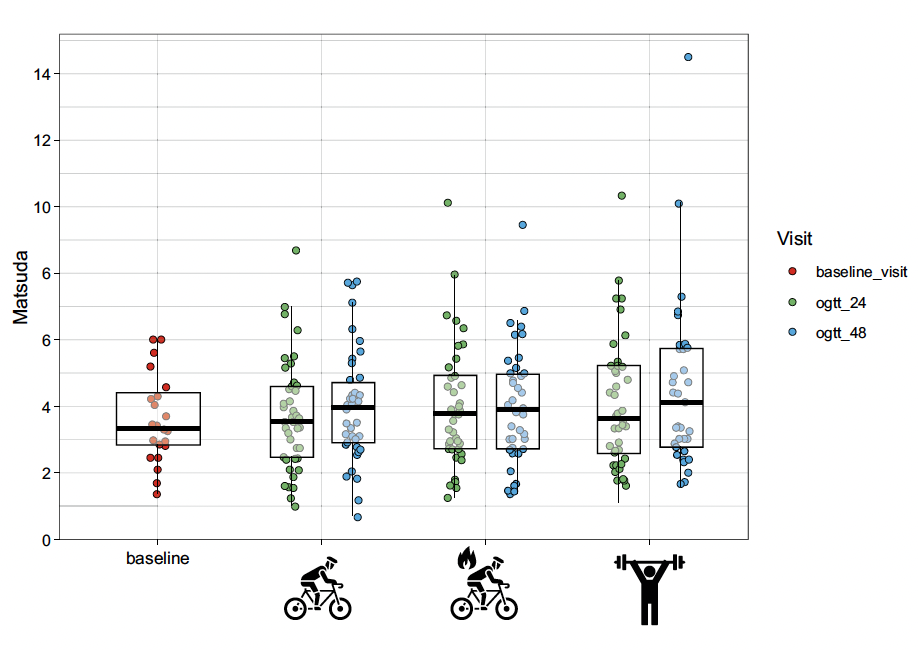
À 24 et à 48 h après la séance d’exercices intensifs, l’indice de Matsuda médian (Q1-Q3) était de 3,6 et 4,0 après un exercice aérobique continu, de 3,8 et 3,9 après HIIT, et de 3,6 et 4,1 UA après un entraînement de force (Fig. 2).
Figure 2 – Amélioration de l’insulinosensivité dans tous les modèles (fondée sur l’HGPO), comparée aux paramètres initiaux (chaque point de couleur représente un individu).
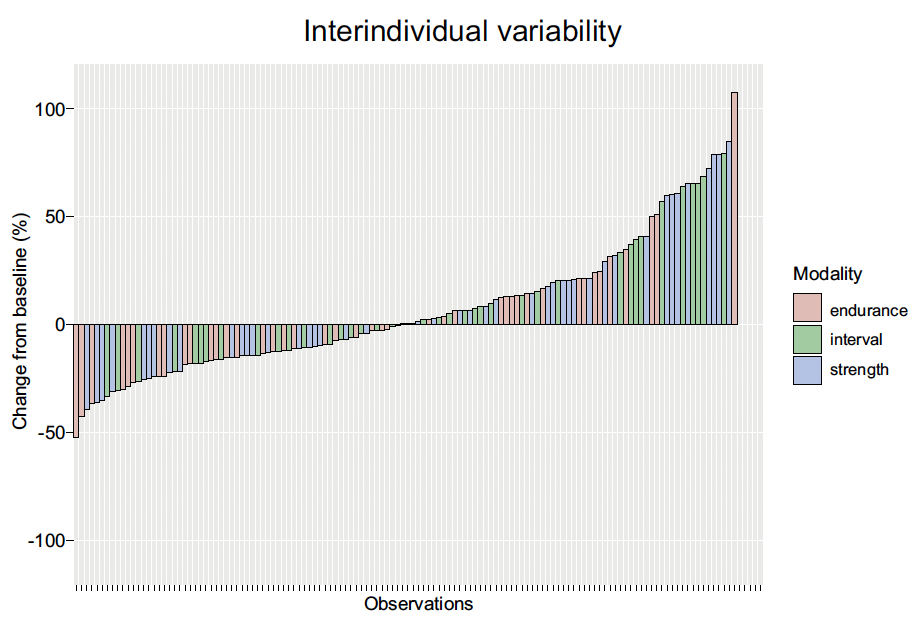
Les variations inter-individuelles des changements induits par l’exercice en matière de sensibilité à l’insuline au cours d’une HGPO, 24 heures après l’exercice, ont une large distribution justifiant une seconde représentation graphique (Fig. 3) qui illustre la gamme des changements comparés à la ligne de base. Celle-ci oscille de -52 à +110 %. Elle indique une hétérogénéité dans la réponse aux interventions, avec toutefois des valeurs majoritairement positives.
Figure 3 – Pourcentage de changement de l’insulinosensiblité comparée à l’index de base après HGPO stratifié selon les trois types d’exercice.
La variation intra-individuelle moyenne de la sensibilité à l’insuline entre les trois interventions avait un écart-type de 22,6 (11,3) %, tandis que la variation intra-individuelle moyenne au sein de la même intervention était de 17,5 (13,0) %.
À retenir
Cette étude montre une amélioration de la sensibilité à l’insuline après une séance d’exercice intense. On note cependant une importante variation inter- et intra-individuelle, sans différences apparentes entre les groupes. L’identification des facteurs contribuant à ces variations est essentielle pour déterminer l’exercice efficace et personnalisé à des fins de prévention.
• Sloth Nielsen N, Ried-Larsen M, Hartman J et al. The response in insulin sensitivity to different modalities of acute exercise. EASD 2024 : #137.
TOP 3 – Effets des collations sur les paramètres cardio-métaboliques de jeunes adultes en surpoids ou obèses
Le comportement sédentaire (CS) est un facteur de risque d’obésité, de maladies cardiovasculaires et de diabète de type 2 (DT2), que l’activité physique (AP) peut atténuer. Cette présentation de l’université de Bayreuth en explore les réponses cardio-métaboliques.
Un essai en cross-over contrôlé et randomisé
Les effets de la position assise prolongée et de la position assise prolongée interrompue par une activité physique, sur les paramètres cardio-métaboliques chez de jeunes adultes en surpoids ou obèses ont ainsi été analysés dans un essai croisé, contrôlé et randomisé.
Les 17 participants (huit femmes ; âge : 23,4 ans ; IMC : 29,7 ± 3,8 kg/m²) ont été répartis en quatre bras d’analyse :
• position assise prolongée (SIT) ;
• position assise interrompue par une position debout (SIT-STAND avec un temps debout accumulé de 2,5 heures par jour) ;
• position debout continue (STAND) ;
• marche continue (1,0 mph/1,61 km/h ; WALK).
Ils ont bénéficié pendant les tests d’un petit-déjeuner et d’un déjeuner standardisés pris au laboratoire.
L’objectif principal était d’étudier comment les changements de position du corps affectent la glycémie moyenne sur 8 heures par rapport à la position assise ininterrompue.
Les objectifs secondaires s’intéressaient aux effets sur la glycémie post-prandiale, sur la fréquence cardiaque (FC) et la variabilité de celle-ci (VFC) sur 8 heures dans chaque groupe.
Les glycémies ont été mesurées toutes les heures ; la FC et la VRC ont été évaluées sur 24 heures, durant la phase d’intervention de 8 heures et à domicile, au moyen d’un électrocardiogramme Holter. Les données ont été analysées au moyen d’une ANOVA avec des tests post-hoc ajustés (p < 0,05).
Les résultats
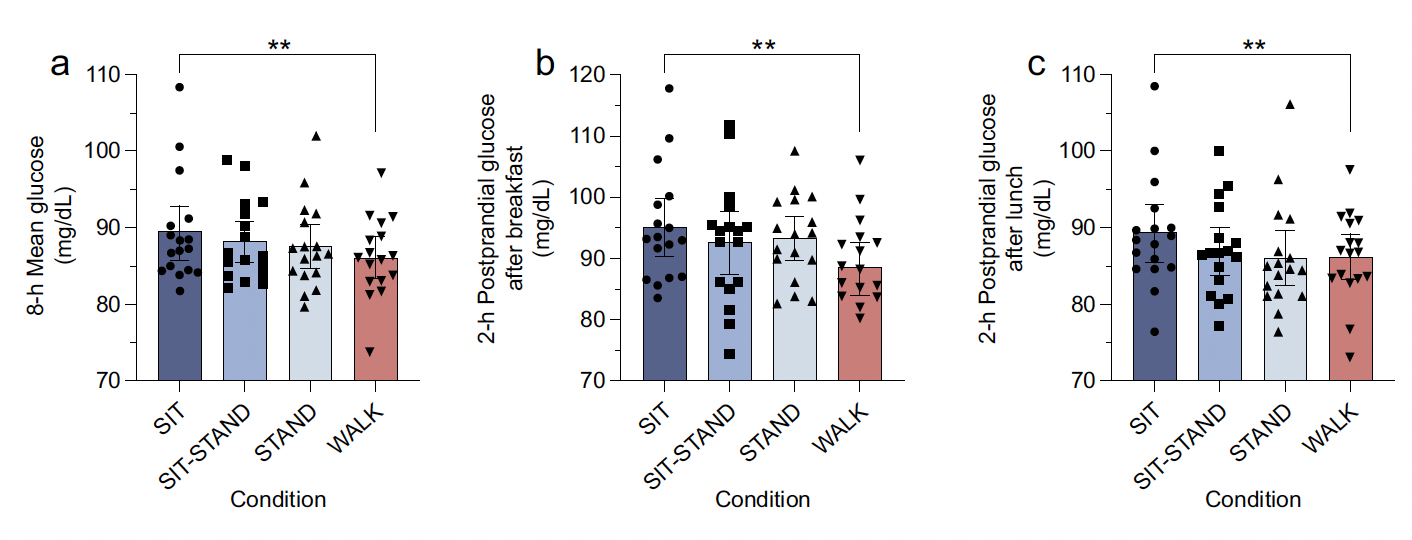
Par rapport à la position de base SIT (89,4 ± 6,8 mg/dl), la glycémie moyenne sur 8 heures était plus faible dans toutes les autres conditions (p < 0,05) et la différence la plus significative était marquée pour WALK (86,3 ± 5,2 mg/dl ; p = 0,034) (Fig. 4a).
La glycémie moyenne post-prandiale 2 heures après le petit-déjeuner était également inférieure d’environ 7 % pour WALK (88,5 ± 8,6 mg/dl ; 4,9 ± 0,5 mmol/l) comparée à SIT (95,3 ± 9,2 mg/dl ; 5,3 ± 0,5 mmol/l ; p = 0,002) (Fig. 4b).
En revanche, aucune différence significative n’a été observée s’agissant de la glycémie post-prandiale 2 heures après le déjeuner (Fig. 4c).
Figure 4 – a) Glycémie moyenne sur 8 heures statistiquement différente entre SIT et WALK. b) Glycémie moyenne 2 h post-prandiale après le petit-déjeuner statistiquement différente entre SIT et WALK. c) Pas de différence en post-prandial après le déjeuner.
Des effets significatifs sur les paramètres de FC et de VRC en faveur de la marche d’intensité légère ont aussi été observés (p < 0,001).
À retenir
Lors d’une activité physique d’intensité légère (marche) de jeunes adultes en surpoids ou obèses, les collations ont un effet glycémique moindre, tout en améliorant la variabilité de la fréquence cardiaque pendant les 8 heures d’observation, comparé aux observations lors de la position assise prolongée, la position assise et debout alternée ainsi que lors de la position debout continue.
• Sanfilippo S, Moser O, Zimmermann P et al. Effects of light-intensity physical activity snacking on cardiometabolic parameters in young adults with overweight/obesity: a randomised controlled crossover trial. EASD 2024 : #136.
TOP 2 – Piezo1 des myofibres régule l’hypertrophie musculaire et le métabolisme en réponse à l’exercice
Le muscle squelettique, organe cible de l’insuline, joue un rôle crucial dans le métabolisme et, en retour, l’exercice physique agit sur le muscle à la fois sur son volume et sa qualité. La régulation négative du canal Ca2+ mécanosensoriel Piezo1 intervenant dans l’atrophie musculaire lors d’une immobilisation, cette présentation japonaise, de l’université de Kobe, s’est intéressée au rôle de Piezo1 dans le remodelage musculaire induit par l’exercice.
Le modèle murin
Pour cette étude musculaire, des souris ont été rendues knock-out (KO) au myofibre spécifique Piezo1 par du tamoxifène administré toutes les 3 semaines afin de maintenir la perturbation.
Après un exercice (roues de course pendant 3 mois) provoquant une hypertrophie musculaire, une ablation des muscles gastrocnémien et soléaire a été réalisée. Dix jours après cette résection, une compensation par une hypertrophie du muscle plantaire s’est ensuite développée après nouvelle activité. Ce dernier a été isolé et soumis à divers tests.
Les résultats
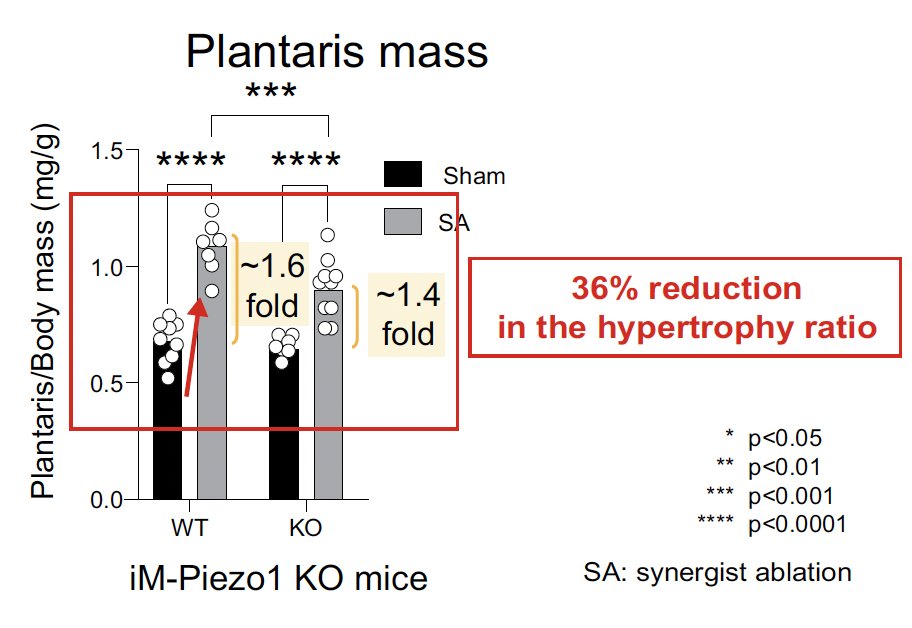
Dans les 10 jours suivant l’ablation musculaire, la masse et l’expression de Piezo1 dans les muscles plantaires ont augmenté respectivement de 1,6 et 2 fois. L’analyse par puce à ADN a révélé que Piezo1 était l’un des gènes les plus régulés à la hausse parmi ceux codant les canaux Ca2+ membranaires au cours de ce processus.
L’altération spécifique de Piezo1 par le tamoxifène a inhibé l’hypertrophie musculaire induite par l’ablation musculaire d’environ 36 % sans affecter l’altération des gènes impliqués dans l’hypertrophie (Fig. 5).
Figure 5 – Réduction de l’hypertrophie musculaire après altération de Piezo1 au tamoxifène.
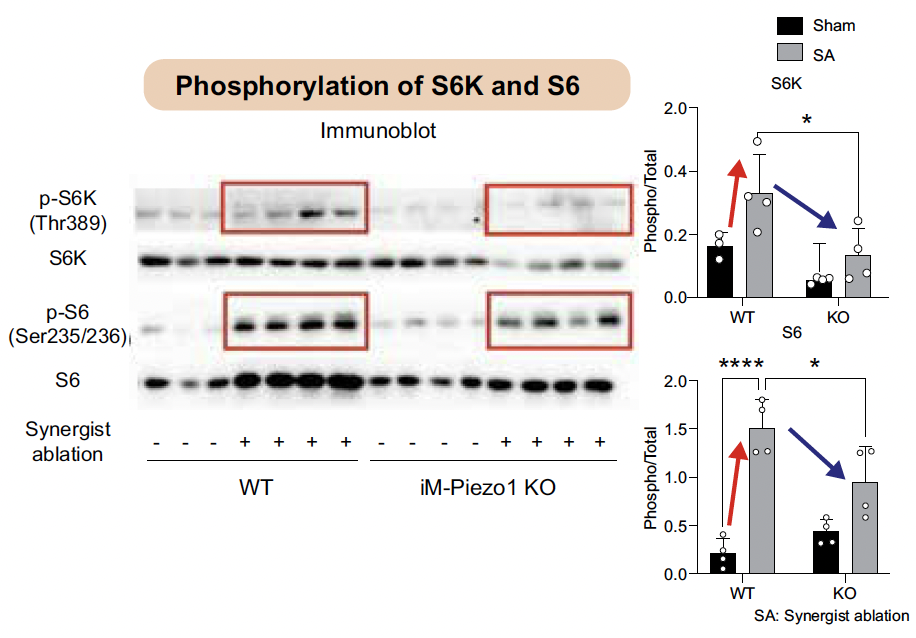
Lors de l’analyse génique du processus de reconstruction musculaire des souris amputées (SA), des souris intactes (SHAM), des souris KO par tamoxifène et de celles non traitées, ni la reconstruction stromale, ni la différentiation myogénique, ni le catabolisme protéique, ne semblent avoir été affectés. Seule la synthèse protéique, et notamment la phosphorylation des protéines S6K/S6, a été altérée (Fig. 6).
Figure 6 – Implication de Piezo1 dans les voies de synthèse protéique notamment dans la phosphorylation de S6K et S6.
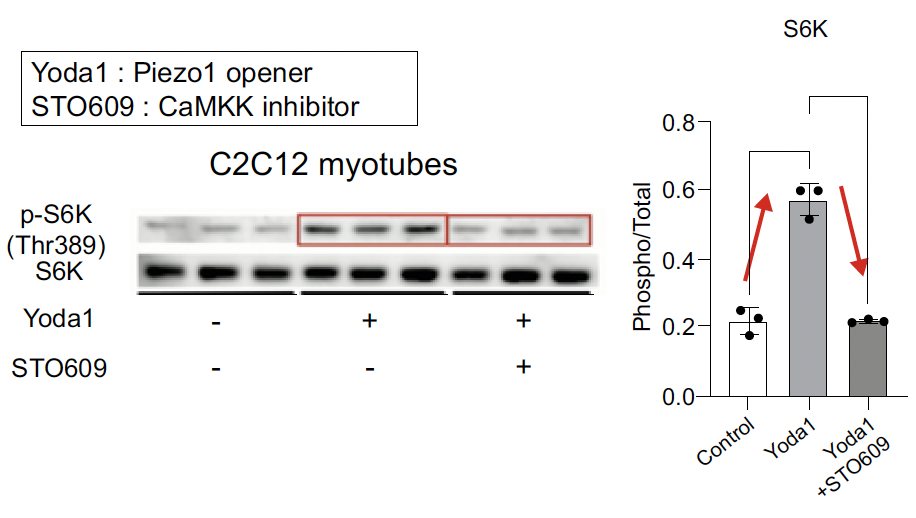
Pour confirmer l’expérience, dans les myotubes C2C12, l’agoniste de Piezo1, Yoda1, a augmenté la phosphorylation de S6K/S6, ensuite inhibée par un inhibiteur de CaMKK (Fig. 7).
Figure 7 – Yoda1 agoniste de Piezo1 augmente la phosphorylation de S6K et S6.
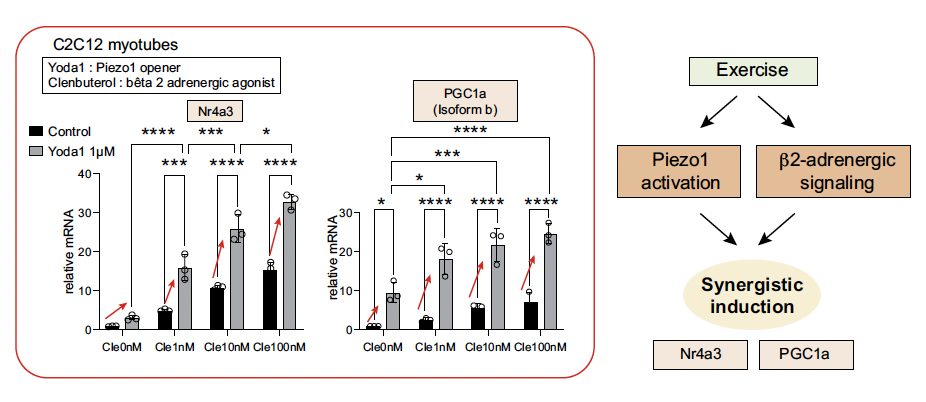
L’ablation musculaire n’étant pas naturelle pour explorer le métabolisme musculaire, une seconde analyse musculaire a porté sur des souris non opérées qui réalisaient des exercices en roues de course. Les résultats ont été les mêmes, Piezo1 régulant positivement les gènes liés aux mitochondries, notamment Ppargc1a et Nr4a3, dans le muscle. Cette régulation a été entravée par l’altération de Piezo1. Dans les myotubes C2C12, Yoda1 a régulé positivement Ppargc1a et Nr4a3 avec l’agoniste β2-adrénergique clenbutérol (Fig. 8).
Figure 8 – L’activation de Piezo1 et des voies β2-adrénergiques durant l’activité physique régule de manière synergique le métabolisme musculaire.
À retenir
Piezo1 dans les myofibres contribue à l’hypertrophie musculaire induite par l’exercice, via la stimulation de la synthèse des protéines. Piezo1 est impliqué dans la régulation des gènes liés au métabolisme musculaire pendant l’exercice aérobique. Son action multiforme dans le muscle squelettique pendant l’exercice suggère qu’il pourrait être une cible thérapeutique en cas de troubles musculaires.
• Oniue T, Nomura K, Ogawa W et al. Myofiber Piezo1 regulates muscle hypertrophy and metabolism in response to exercise. EASD 2024 : #134.
TOP 1 – Analyse du méthylome et du transcriptome du muscle squelettique après exercice chez des femmes diabétiques de type 2 comparées à des femmes à la tolérance glycémique normale
Les modifications épigénétiques par méthylation de l’ADN contribuent à la régulation du métabolisme du muscle squelettique. Les mécanismes moléculaires de l’activité physique régulière, reconnue comme bénéfique au contrôle du DT2, méritent un approfondissement proposé par cette présentation suédoise. Leur étude s’est focalisée sur les altérations de la méthylation de l’ADN et de l’expression transcriptionnelle du muscle squelettique, en réponse à l’exercice, lors d’un DT2 comparé à une tolérance normale au glucose.
Des biopsies musculaires après effort
Vingt femmes DT2 et 14 femmes à la tolérance glycémique normale ont effectué un exercice de 35 minutes sur un vélo à 85 % de la fréquence cardiaque maximale. Des biopsies du muscle vaste latéral ont été effectuées avant, immédiatement et 3 heures après l’exercice. L’ARN et l’ADN totaux ont été isolés à partir de tissus de biopsie pour réaliser des analyses de transcriptome et de méthylation.
Les résultats
L’exercice a induit des altérations temporelles de la méthylation de l’ADN dans le muscle des DT2 comme des femmes à la tolérance glycémique normale.
En revanche, comparées aux femmes à la normo-tolérance, les DT2 présentaient un nombre plus élevé de sites CpG et de régions différentiellement méthylées (DMR) avec de plus importantes réponses de méthylation de l’ADN au repos versus pré-repos (sites CpG = 11 187, DMR = 3 143).
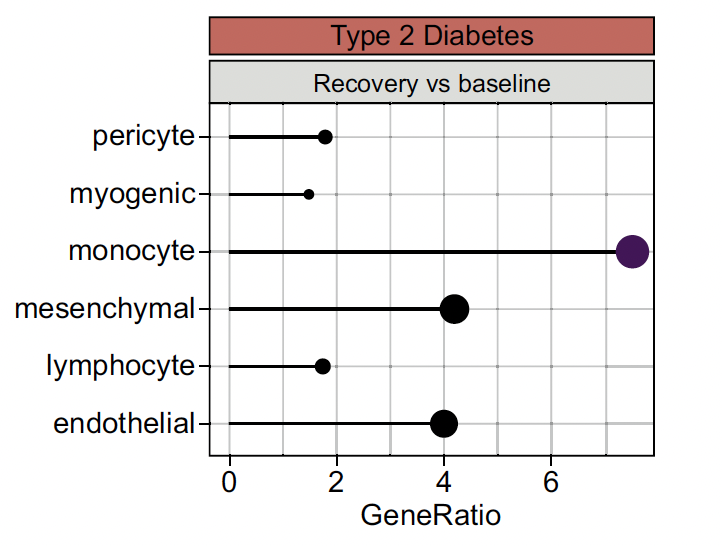
L’analyse des voies des sites CpG et des DMR en réponse à l’exercice a identifié un enrichissement de la réponse immunitaire, de la fonction leucocytaire et de l’activation des lymphocytes T dans le muscle squelettique, similaire dans les deux groupes de femmes, en dehors de l’activité monocytaire majorée chez les diabétiques (Fig. 9). Chez les DT2, un enrichissement supplémentaire a été observé dans les voies liées au développement cellulaire, notamment la signalisation cellulaire, l’activation cellulaire et l’organisation du cyto-squelette. Lors de la récupération, une réponse transcriptionnelle quantitativement plus importante a également été observée et les gènes différentiellement exprimés (DEG) en réponse à l’exercice étaient enrichis dans les voies liées à la présentation des antigènes.
Figure 9 – Majoration de l’expression génique monocytaire chez les diabétiques de type 2.
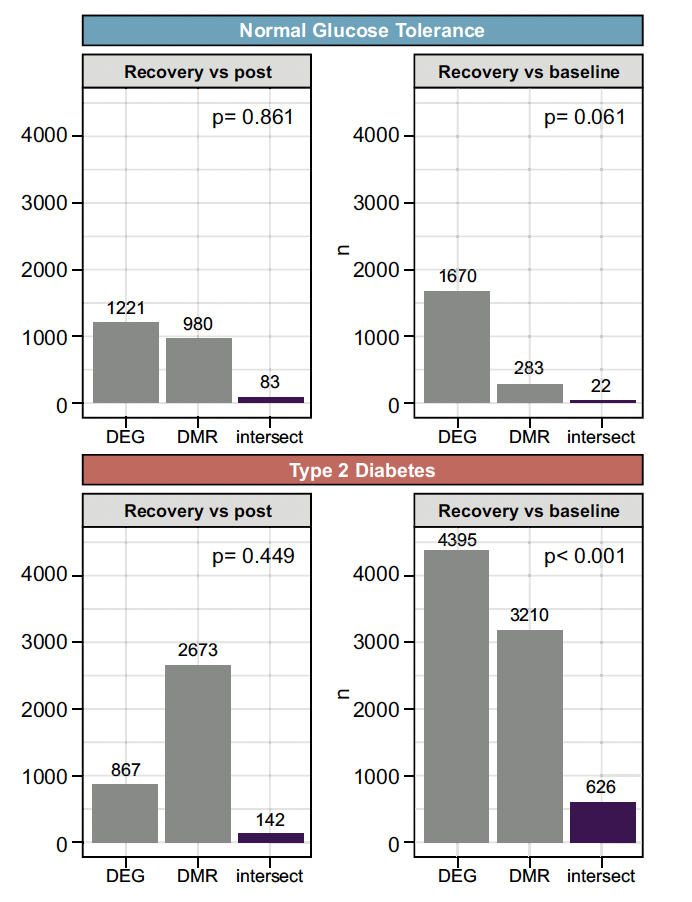
Le lien entre les DMR et les DEG en réponse à l’exercice n’a été noté que chez les DT2 (N = 626, 19,5 %), avec un enrichissement des voies liées à la réponse immunitaire et au remodelage cellulaire (Fig. 10).
Figure 10 – Méthylation de l’ADN dans le muscle des diabétiques de type 2 en réponse à un exercice physique.
Une analyse plus approfondie de ce sous-ensemble de gènes croisés a identifié huit DMR qui étaient corrélés avec leur DEG correspondant : ARHGAP15, BIN2, DOCK2, DOCK8, GNAI2, HLA-DMB, PLEK et WIPF1.
À retenir
Les profils de méthylation de l’ADN et de transcriptome du muscle squelettique diffèrent entre les femmes atteintes de DT2 et celles ayant une tolérance normale au glucose, avec une signature immunogène accrue en réponse à l’exercice chez les DT2. Ces altérations de la méthylation de l’ADN en réponse à l’exercice servent à réguler les réponses immunitaires et le remodelage cellulaire chez celles-ci.
• MacGrego K, Zierath JR, Krook A. Integrated analysis of the skeletal muscle methylome and transcriptome following exercise in females with type 2 diabetes and normal glucose tolerance. EASD 2024 : #138.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.