La transplantation d’îlots de Langerhans apporte des bénéfices métaboliques indéniables aux patients diabétiques de type 1, mais elle est limitée par la rareté des greffons, l’immunosuppression et la perte de fonctionnalité du greffon. Le développement d’un pancréas bioartificiel, utilisant des îlots issus de cellules souches différenciées et encapsulés dans un macro-
device, pourrait surmonter ces obstacles et offrir une solution thérapeutique prometteuse.
Résumé
La transplantation d’îlots de Langerhans, désormais remboursée, offre aux patients atteints de diabète de type 1 instable une protection efficace contre les hypoglycémies sévères, améliore la stabilité glycémique et leur qualité de vie. Cependant, la greffe reste limitée par la perte progressive de fonctionnalité des îlots, la nécessité d’utiliser plusieurs pancréas pour un seul receveur, et les défis associés à l’implantation et à la revascularisation des îlots. Le développement du pancréas bioartificiel pourrait résoudre ces problèmes en offrant une source continue de cellules sécrétrices d’insuline et en utilisant des techniques d’encapsulation pour protéger les îlots du rejet allogénique. L’étude clinique VX-880, utilisant des cellules souches différenciées en îlots pancréatiques, montre des résultats extrêmement prometteurs. Une autre approche explore l’encapsulation de ces îlots issus de cellules souches pour supprimer la nécessité d’immunosuppresseurs, avec l’étude VX-264 qui teste la macroencapsulation des îlots. Malgré les défis, notamment la vascularisation des dispositifs et la biocompatibilité, cette technologie pourrait transformer le traitement du diabète, mais nécessite probablement encore des améliorations techniques pour garantir la viabilité à long terme des greffons.
Abstract
Bioartificial pancreas: towards the end of insulin therapy for all?
Islet transplantation, which is now reimbursed, offers patients with unstable type 1 diabetes effective protection against severe hypoglycaemia, improves glycaemic stability and quality of life. However, transplantation remains limited by the progressive loss of islet functionality, the need to use several pancreases for a single recipient, and the challenges associated with islet implantation and revascularisation. The development of the bioartificial pancreas could solve these problems by providing a continuous source of insulin-secreting cells and using encapsulation techniques to protect the islets from allogeneic rejection. The VX-880 clinical trial, using stem cells differentiated into pancreatic islets, is showing extremely promising results. Another approach explores the encapsulation of these stem cell-derived islets to eliminate the need for immunosuppressants, with the VX-264 study testing macroencapsulation of islets. Despite challenges such as device vascularisation and biocompatibility, this technology could transform the treatment of diabetes, but probably still requires further technical improvements to ensure the long-term viability of the grafts.
La transplantation d’îlots : une technique innovante
La transplantation d’îlots de Langerhans repose sur un processus complexe et hautement spécialisé.
Le prélèvement du pancréas et l’isolement des îlots
Elle commence par le prélèvement d’un pancréas dans le cadre d’un prélèvement multi-organe. Ce pancréas est ensuite transporté dans une unité de thérapie cellulaire où commence la procédure d’isolement des îlots. Cette dernière implique plusieurs étapes : la perfusion du pancréas avec une solution enzymatique de collagénase, suivie de sa digestion mécanique et enzymatique, puis la séparation des îlots par centrifugation sur un gradient de densité. Après contrôles qualité sur la pureté, la viabilité et la quantité des îlots, seuls les greffons répondant aux critères sont envoyés au centre greffeur.
La transplantation d’îlots
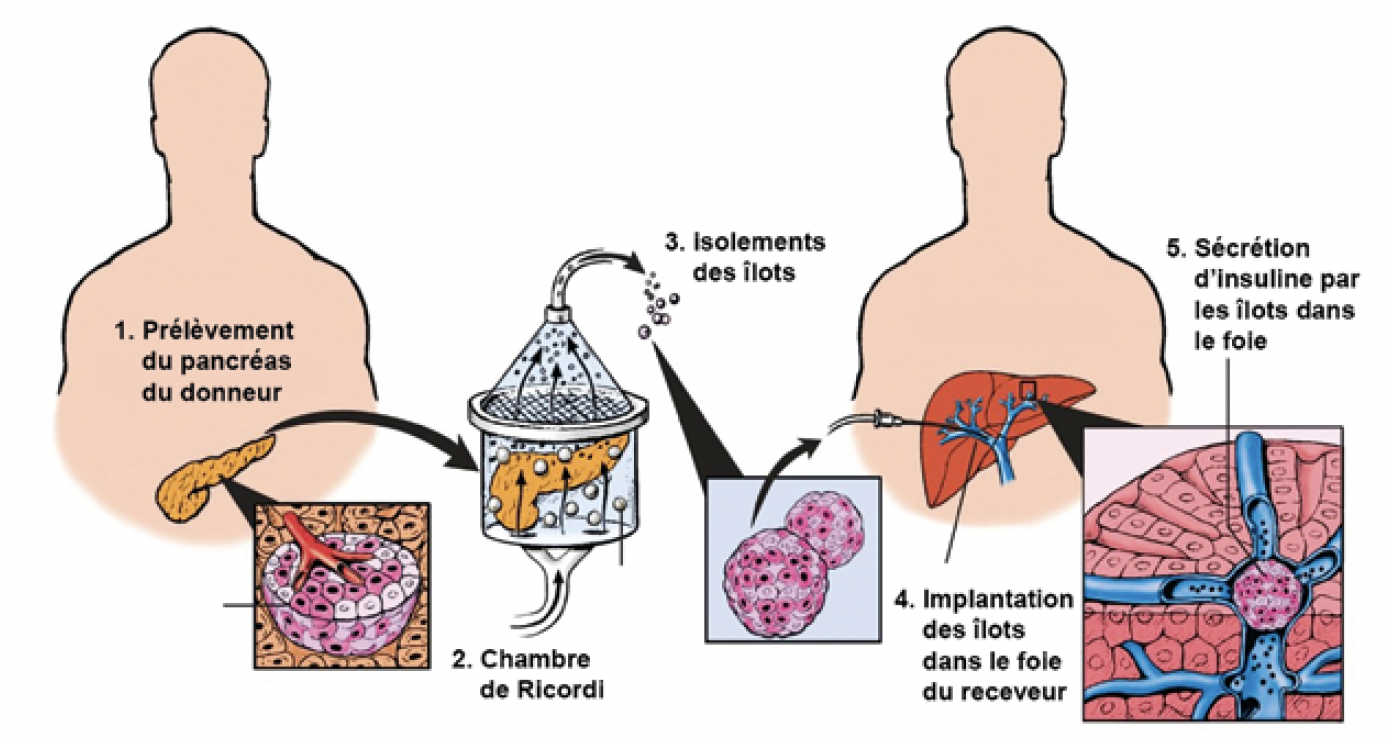
La transplantation d’îlots se fait par une technique mini-invasive percutanée, avec infusion des îlots dans une branche de la veine porte (Fig. 1). Ces îlots sont ensuite emportés par le flux sanguin portal jusqu’aux capillaires hépatiques, où ils s’implantent et forment une nouvelle masse endocrine fonctionnelle dans le parenchyme hépatique.
Figure 1 – La transplantation d’îlots adaptée de ©Diabetes Research Institute, University of Miami / artist: Robert Margulies.
L’immunosuppression
Comme pour toute transplantation d’organe, la transplantation d’îlots nécessite une immunosuppression adaptée. Un protocole classique inclut une induction par thymoglobuline associée à un inhibiteur du TNF-alpha (étanercept), suivie d’un traitement de maintenance combinant mycophénolate mofétil et tacrolimus. Ces traitements, bien qu’absolument nécessaires, ne sont pas sans risques et exposent le patient receveur à une néphrotoxicité, un surrisque infectieux et un risque de néoplasies à long terme.
Les bénéfices de la transplantation d’îlots pour les patients
Chez les patients atteints de diabète de type 1 (DT1) instable, la transplantation d’îlots pancréatiques apporte des bénéfices cliniques et métaboliques significatifs.
Une stabilité glycémique durable
Cinq ans après la greffe, plus de 90 % des receveurs ne décrivent plus d’hypoglycémies sévères, un contraste marqué avec leur état pré-greffe où ces épisodes étaient systématiques. Cette disparition s’accompagne d’une restauration de la sensibilité aux hypoglycémies.
Une amélioration de l’HbA1c
À 5 ans, environ deux tiers des patients maintiennent une HbA1c inférieure à 7 %, reflétant une amélioration durable de leur équilibre glycémique global.
Une qualité de vie améliorée
Les receveurs rapportent une réduction significative de la peur des hypoglycémies et une plus grande satisfaction vis-à-vis de leur traitement, contribuant à une meilleure qualité de vie globale.
Une amélioration de la survie du patient
Et l’insulino-indépendance ?
Le taux d’insulino-indépendance, le Graal de la transplantation chez le patient vivant avec un DT1, s’est notablement amélioré ces dernières années grâce aux avancées techniques. Actuellement, environ 60 % des receveurs sont insulino-indépendants 1 an après la transplantation. Cependant, cette insulino-indépendance n’est pas durable pour la majorité des patients : seuls 27 % des receveurs restent insulino-indépendant à 5 ans, et 5 % à 10 ans (1).
Les limites actuelles de la transplantation d’îlots
Malgré ses bénéfices, la transplantation d’îlots présente plusieurs limitations majeures (2).
La consommation en organes
Pour chaque receveur, deux ou trois pancréas sont nécessaires, car le rendement de l’isolement des îlots reste faible.
Le recours à l’immunosuppression
Le traitement immunosuppresseur expose le patient receveur à une néphrotoxicité, à un surrisque infectieux et à un risque de néoplasies à long terme limitant l’extension de la technique à l’ensemble des patients DT1.
L’efficacité métabolique sur le long terme
Bien que prometteuse, cette approche n’atteint pas encore les résultats observés avec une transplantation complète de pancréas. La perte de fonctionnalité du greffon sur le long terme reste une problématique importante.
Les causes de cette perte de fonctionnalité sont multiples :
• dommages liés à l’isolement des îlots : la séparation du pancréas endocrine et exocrine, par digestion enzymatique, entraîne une ischémie temporaire des îlots, perturbe leur matrice extracellulaire (ECM) et provoque une apoptose par anoïkis ;
• limites du site d’implantation : l’injection intra-portale des îlots entraîne une réponse inflammatoire immédiate appelée IBMIR (Instant Blood-Mediated Inflammatory Reaction). Ce processus entraîne des phénomènes d’immuno-thrombose responsables de la perte de 50 % des îlots dès la phase post-greffe immédiate.
De plus, les îlots implantés dans le foie sont exposés à une gluco-lipotoxicité locale ainsi qu’à la toxicité des immunosuppresseurs. Enfin, des facteurs immunologiques, tels que le rejet allogénique et la récurrence de l’auto-immunité, compromettent également leur viabilité à long terme.
Le pancréas bioartificiel, une perspective d’avenir
Le pancréas bioartificiel représente une perspective thérapeutique visant à surmonter les principales limites des greffes d’îlots actuelles, telles que la rareté des îlots disponibles, la nécessité d’une immunosuppression, la perte du microenvironnement naturel des îlots et la difficulté à maintenir leur fonctionnalité à long terme.
Le cahier des charges
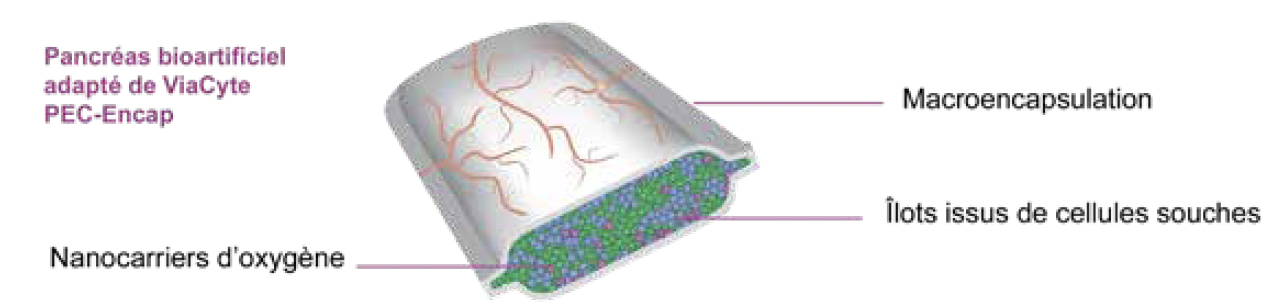
La conception de ce dispositif repose sur un cahier des charges rigoureux fondé sur plusieurs critères essentiels (3) (Fig. 2) :
• une sécrétion d’insuline durable, idéalement à vie ;
• une protection mécanique et immunitaire efficace du greffon ;
• une parfaite biocompatibilité avec le greffon et le site d’implantation ;
• une oxygénation optimale pour assurer la viabilité du greffon ;
• la création d’un microenvironnement propice à la survie et au bon fonctionnement des îlots ;
• une implantation simple et pratique du dispositif.
Figure 2 – Pancréas bioartificiel (image issue de (6)).
Le principe
Le développement du pancréas bioartificiel repose sur deux axes majeurs :
• une source illimitée de cellules sécrétrices d’insuline (via les cellules souches ou la xénotransplantation)
• et l’encapsulation des îlots pancréatiques, qu’elle soit micro ou macro-encapsulation.
La différenciation de cellules souches en cellules souches sécrétrices d’insuline
Sur le premier point, les avancées les plus prometteuses concernent la différenciation de cellules souches en cellules sécrétrices d’insuline, en phase d’évaluation clinique. La société Vertex mène actuellement une étude de phase I/II (étude FORWARD, VX-880) visant à évaluer la sécurité et l’efficacité de cellules souches embryonnaires humaines différenciées en îlots pancréatiques.
Les résultats
Les résultats préliminaires, présentés cette année aux congrès de l’ADA et de l’EASD, se révèlent très encourageants. Quatorze patients atteints de DT1 et présentant des hypoglycémies sévères ont été greffés sous immunosuppression. Bien que deux décès aient été enregistrés (sans lien avec les cellules greffées), tous les patients ayant reçu une dose complète de VX-880 ont atteint une HbA1c inférieure à 7 % et ne rapportent plus d’hypoglycémies sévères.
Trois mois après le traitement complet, les résultats montrent (4) :
• un temps moyen passé dans la cible glycémique (70-180 mg/dl) de 88,5 %, sans épisode d’hypoglycémie ;
• sept patients sont devenus insulino-indépendants, tandis que deux ont réduit leurs doses d’insuline de 70 % et un autre de 24 %.
À 12 mois de suivi, les données pour quatre patients indiquent un temps moyen passé dans la cible de 95,5 %, avec une insulino-indépendance pour tous les patients.
Ces résultats confirment le potentiel des cellules souches différenciées comme solution thérapeutique révolutionnaire pour les patients atteints de DT1.
Étude VX-264 et l’encapsulation des îlots, un espoir pour l’arrêt des immunosuppresseurs
Vertex, après rachat de la société Viacyte, mène actuellement une seconde étude clinique, VX-264, s’appuyant sur le deuxième pilier du concept de pancréas bioartificiel : l’encapsulation des îlots pancréatiques.
Le principe
Cette technologie vise à interposer une barrière physique entre les îlots greffés et le système immunitaire, avec l’ambition de réduire, voire d’éliminer, le recours aux traitements immunosuppresseurs. Deux approches d’encapsulation se distinguent aujourd’hui :
• la macroencapsulation, consistant à loger les îlots dans des macrochambres ;
• la microencapsulation, qui enferme chaque îlot dans des microcapsules de biopolymères.
L’étude VX-264 explore la sécurité, la tolérance et l’efficacité d’îlots allogéniques issus de cellules souches, greffés sans immunosuppression dans un dispositif de macroencapsulation. Si les résultats préliminaires ne sont pas encore disponibles, ils sont très attendus, car cette technique soulève des défis significatifs.
Les défis
Le principal obstacle réside dans l’absence de vascularisation des dispositifs de macroencapsulation, ce qui complique le maintien de la viabilité du greffon. Par ailleurs, une biocompatibilité optimale est essentielle pour éviter des phénomènes de fibrose autour des dispositifs, susceptibles d’aggraver la perte de viabilité cellulaire en favorisant une réponse inflammatoire locale.
Plusieurs pistes sont explorées pour surmonter ces défis :
• amélioration de la biocompatibilité : le revêtement des dispositifs avec du polyéthylène glycol (PEG) ou autre polymère a montré des effets prometteurs en empêchant l’adhésion du fibrinogène et en réduisant la prolifération fibreuse autour des microcapsules ;
• optimisation de l’oxygénation : l’incorporation de nanocarriers d’oxygène dans les dispositifs est une voie innovante pour assurer un apport en oxygène continu et optimal aux cellules encapsulées. Par exemple, des nanocarriers à base de fluorure ont démontré leur capacité à prolonger la survie cellulaire en améliorant le transport et la disponibilité de l’oxygène dans des études récentes (5).
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Lablanche S, Borot S, Wojtusciszyn A et al. Ten-year outcomes of islet transplantation in patients with type 1 diabetes: Data from the Swiss-French GRAGIL network. Am J Transplant 2021 ; 21 : 3725‑33.
2. Langlois A, Pinget M, Kessler L, Bouzakri K. Islet transplantation: current limitations and challenges for successful outcomes. Cells 2024 ; 13 : 1783.
3. Berney T, Wassmer CH, Lebreton F et al. From islet of Langerhans transplantation to the bioartificial pancreas. Presse Méd 2022 ; 51 : 104139.
4. ADA PressRelease. Expanded FORWARD Trial Demonstrates Continued Potential for Stem Cell-Derived Islet Cell Therapy to Eliminate Need for Insulin for People with T1D. 21 juin 2024. Disponible sur : diabetes.org/sites/default/files/2024-06/ADA_Vertex_PressRelease_FINAL.pdf.
5. Zheng Y, Yang W, Gao W et al. A Bioartificial pancreas with “immune stealth” and continuous oxygen supply for islet transplantation. Macromol Rapid Commun 2023 ; 44 : 2300383.
6. Dang HP, Chen H, Dargaville TR, Tuch BE. Cell delivery systems: Toward the next generation of cell therapies for type 1 diabetes. J Cell Mol Med 2022 ; 26 : 4756‑67.