La douleur peut être le symptôme initial d’une polyneuropathie sensitive ou survenir au cours de son évolution. Toute lésion ou maladie affectant le système somatosensoriel périphérique ou central peut entraîner non seulement une perte de fonction, mais aussi une sensibilité accrue à la douleur (allodynie, hyperalgésie) et/ou une douleur spontanée continue ou paroxystique. La douleur neuropathique correspond à une douleur liée à une lésion ou une maladie du système nerveux somatosensoriel (1).
Du fait de leurs mécanismes particuliers, les douleurs neuropathiques sont difficiles à traiter et nécessitent des traitements spécifiques. Les antalgiques de palier 1 de l’OMS (paracétamol, anti-inflammatoires non stéroïdiens, salycilés) et de palier 2 (poudre d’opium, codéine, néfopam), à l’exception du tramadol, sont inefficaces. Il en est de même pour les neuroleptiques et les benzodiazépines.
Cette revue abordera les traitements purement symptomatiques de la douleur des neuropathies ainsi que les recommandations nationales et internationales concernant ces douleurs. Au préalable, nous évoquerons les aspects cliniques ou diagnostiques, puis présenterons brièvement les traitements spécifiques de la neuropathie diabétique.
La neuropathie douloureuse du diabète
Présentation clinique
Les neuropathies diabétiques les plus fréquemment pourvoyeuses de douleurs sont celles qui affectent les fibres nociceptives (A-delta et C), qu’il s’agisse d’une lésion isolée (on parle alors de neuropathies à petites fibres) ou associée aux lésions des fibres myélinisées de gros calibre (neuropathies axonales). La douleur survient le plus souvent au sein du territoire déficitaire (2). La distribution des douleurs dans les polyneuropathies, forme de neuropathies les plus fréquentes dans le diabète, est généralement étendue, bilatérale et symétrique, au niveau distal touchant le plus souvent les pieds et les chevilles (on parle alors de distribution “en chaussettes”) et parfois les mains (distribution “en gants”), mais pouvant, dans les formes très évoluées, atteindre la région péri-ombilicale et le cuir chevelu, du fait de l’atteinte longueur dépendante des fibres affectées. Elle peut rarement avoir une distribution proximale (tronc, cuisses, jambes, bras) lorsque les ganglions sensoriels sont touchés : on parle alors de ganglionopathie.
Démarche clinique
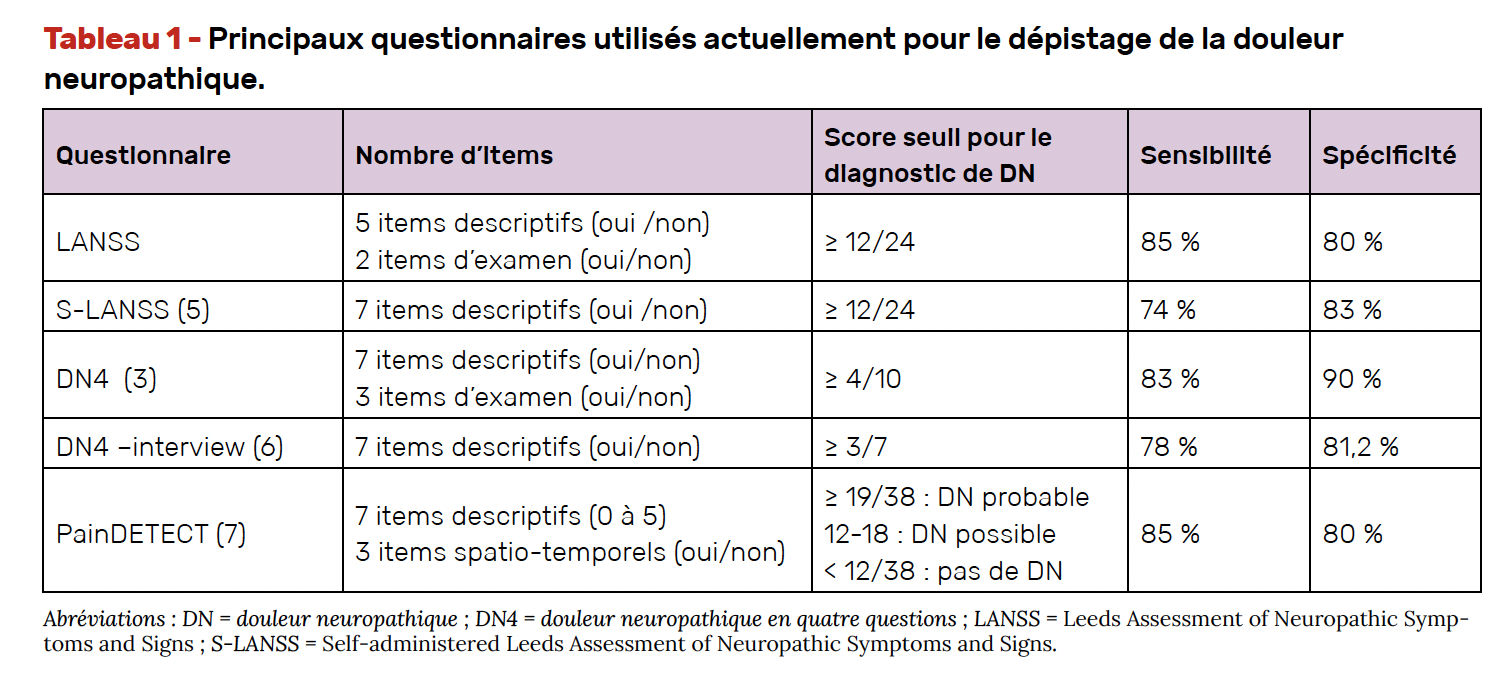
La démarche clinique devant un patient souffrant de douleur neuropathique vise en premier lieu à confirmer le diagnostic. Celui-ci repose sur l’interrogatoire, l’examen clinique et l’anamnèse. De nombreux questionnaires de dépistage ont été développés et validés depuis plus de 20 ans dans cet objectif (Tab. 1).
Le DN4
En France, le DN4 est le questionnaire de référence pour le dépistage des douleurs neuropathiques. Il comporte sept items d’interrogatoire et trois items d’examen clinique, cotés chacun de façon dichotomique (oui/non). L’orientation vers une douleur neuropathique peut être évoquée en cas de réponse positive à au moins quatre items sur 10, avec une sensibilité de 83 % et une spécificité de 90 % dans l’étude princeps (3).
Les examens complémentaires
Cette démarche clinique peut être complétée par des examens complémentaires pour confirmer l’atteinte du système somatosensoriel (4), même si ces examens sont rarement nécessaires dans la neuropathie diabétique. L’EMG, qui évalue les fibres de gros calibre, pouvant être normal dans les neuropathies débutantes, plusieurs tests évaluent les fibres nociceptives, souvent les premières touchées : tests quantifiés sensoriels, potentiels évoqués laser, biopsie cutanée et microscopie cornéenne confocale.
Enfin, un algorithme diagnostique prenant en compte des éléments cliniques et complémentaires permet de classer les douleurs neuropathiques en possibles, probables ou définies (1).
Les traitements spécifiques
Traitement du diabète
Des études majeures ont démontré que l’obtention d’une glycémie proche de la normale réduit significativement le risque de survenue ou de progression de la neuropathie. Par ailleurs, la prise en charge globale des facteurs de risque cardiovasculaire est indispensable. Une stratégie thérapeutique combinant antihypertenseurs, statines et sevrage tabagique permet de réduire la progression de la neuropathie (8).
Traitements pathogéniques de la neuropathie diabétique
Ces traitements visent à améliorer la neuropathie proprement dite et sont généralement bien tolérés, mais leur efficacité dans les douleurs neuropathiques est bien moins établie. Ils n’ont pas d’AMM en France pour le traitement des neuropathies douloureuses, mais certains sont utilisés dans d’autres pays européens. Ils incluent l’acide alpha-lipoïque, la thiamine (vitamine B1), et son dérivé liposoluble, le benfotiamine, l’actovégine, l’épalrestat, inhibiteur de l’aldose réductase, l’acétyl L-carnitine, dérivé de la carnitine, et l’acide gamma-linolénique.
Agonistes du récepteur du GLP-1
Les agonistes du récepteur du GLP-1 (GLP-1RA) présentent un intérêt croissant dans la neuropathie diabétique. Le liraglutide, en particulier (9), semble améliorer significativement la fonction axonale, indépendamment de ses effets glycémiques. Les mécanismes semblent impliquer une réduction du stress oxydatif. Ainsi, les GLP-1RA pourraient jouer un rôle neuroprotecteur, en ralentissant la progression de la neuropathie diabétique et en préservant la fonction nerveuse.
Les traitements symptomatiques
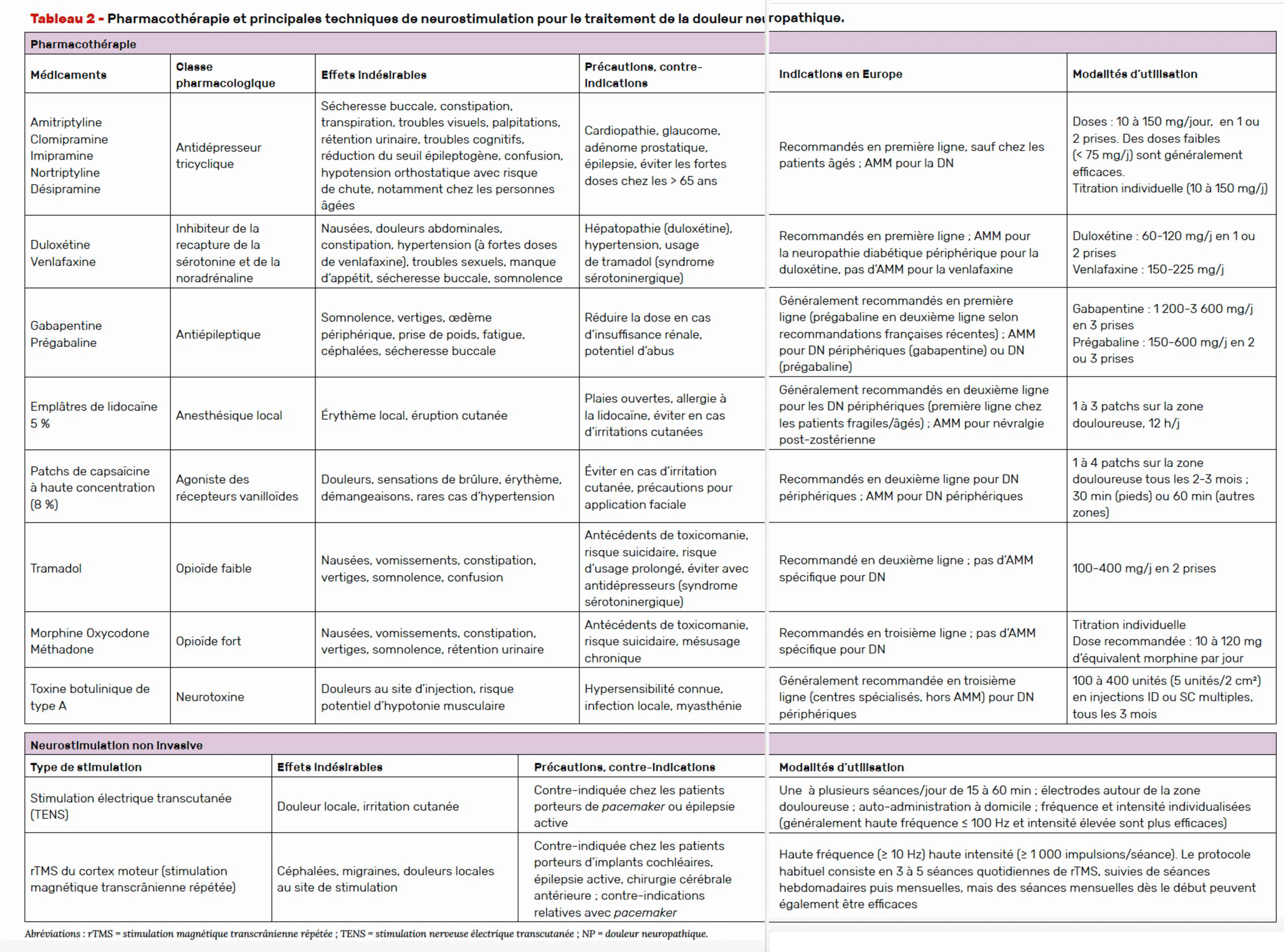
La prise en charge des douleurs neuropathiques, comme toutes les douleurs chroniques, nécessite une approche globale et multimodale. En complément des traitements pharmacologiques (Tab. 2), les techniques non médicamenteuses se révèlent souvent indispensables. La psychothérapie, en particulier les approches cognitivo-comportementales, permet d’accompagner l’incidence émotionnelle et psychologique de la douleur, tandis que l’activité physique adaptée aide à préserver la mobilité et à réduire la douleur perçue. L’éducation thérapeutique favorise une meilleure compréhension de sa maladie et une plus grande autonomie dans la gestion des symptômes. Enfin, les traitements complémentaires (relaxation, hypnose, méditation) peuvent renforcer l’efficacité des autres approches.
Traitements systémiques
Les antidépresseurs tricycliques
L’efficacité des antidépresseurs tricycliques est largement établie dans la neuropathie douloureuse diabétique (10-14). Ces traitements agissent sur les contrôles inhibiteurs descendants noradrénergiques, mais ils ont aussi des propriétés stabilisantes de membrane et probablement aussi des effets directs sur les récepteurs bêta-2-adrénergiques (15). Ils doivent faire l’objet d’une surveillance rapprochée à des doses élevées (> 75 mg par jour) en raison de leurs risques potentiels d’hypotension et de toxicité cardiaque. Des doses plus faibles sont à privilégier.
Les antidépresseurs inhibiteurs de recapture de la sérotonine et de la noradrénaline (IRSNA)
Les antidépresseurs inhibiteurs de recapture de la sérotonine et de la noradrénaline (venlafaxine, duloxétine) agissent sur les contrôles modulateurs de la douleur en renforçant les inhibiteurs descendants monoaminergiques. Ils sont recommandés en première intention (10, 12).
Les antiépileptiques
Parmi les antiépileptiques, la gabapentine et la prégabaline restent des traitements de référence de la douleur neuropathique (10, 12). Ces dernières années, l’attention a cependant été portée sur le risque potentiel d’abus et de mauvaise utilisation de ces molécules, en particulier de la prégabaline, et sur l’augmentation du risque de dépression respiratoire, voire de mortalité, en cas d’association avec des opioïdes à forte dose (10, 12, 16). En France, la prégabaline est devenue le premier médicament des prescriptions falsifiées en 2019 (10, 17). En France, elle est soumise à une prescription sur ordonnance sécurisée depuis mai 2021. Cela implique l’utilisation d’un formulaire spécifique (ordonnance sécurisée), la mention obligatoire de la durée du traitement, ainsi qu’une limitation de la durée de prescription à 6 mois. Une surveillance régulière du patient est recommandée, notamment en cas d’antécédents de troubles addictifs. Les autres antiépileptiques ont des résultats négatifs ou inconstants.
Les opiacés
Le tramadol, opioïde faible et inhibiteur de la recapture de la sérotonine, et les opioïdes forts sont modérément efficaces (11). À long terme, les opiacés sont à risque de dépendance et de mésusage, d’où une nécessité d’addictovigilance (1, 3, 11). Les opioïdes faibles ou forts sont soumis à une réglementation stricte en raison de leur potentiel élevé de dépendance, d’abus et de surdosage. En France, depuis le 1er mars 2025, les médicaments contenant de la codéine, de la dihydrocodéine ou du tramadol doivent être prescrits sur une ordonnance sécurisée, comme les opioïdes forts.
Les combinaisons
L’intérêt de l’association d’anti-dépresseurs à la prégabaline ou à la gabapentine a été confirmé, l’association de ces médicaments à des doses modérées pouvant être efficace lorsque la monothérapie à doses modérées ne l’est pas. Une très large étude multicentrique, OPTION-DM, a souligné l’intérêt des combinaisons duloxétine ou tricycliques et prégabaline dans la neuropathie douloureuse du diabète (18).
Traitements topiques ou locaux
Les emplâtres de lidocaïne
L’efficacité des emplâtres de lidocaïne 5 % (AMM douleurs post-zostériennes), qui agissent comme bloqueurs des canaux sodiques, a été établie surtout dans les douleurs post-zostériennes (19, 20). Bien que leur bénéfice soit modéré, la remarquable sécurité d’emploi constitue un avantage substantiel, notamment chez les personnes âgées.
Les patchs de haute concentration de capsaïcine
La capsaïcine, agoniste des récepteurs vanilloïdes (TRPV1) situés sur les fibres nociceptives, agit en activant ces récepteurs. Après plusieurs jours d’application, les neurones sensoriels contenant les récepteurs TRPV1 sont défonctionnalisés, ce qui réduit la transmission douloureuse. L’efficacité à long terme (3 mois) d’application de patchs de capsaïcine à haute concentration (8 %) (AMM) appliquée sur l’aire douloureuse a été démontrée dans les neuropathies sensitives (21-23) et dans la neuropathie douloureuse du diabète (24).
La toxine botulinique A
La toxine botulinique de type A, neurotoxine utilisée dans le traitement de la dystonie et de la spasticité focale, s’est avérée avoir des effets analgésiques dans la douleur neuropathique, dont la poly-neuropathie douloureuse du diabète (28-30). Ce traitement est en dispensation hospitalière et doit être prescrit par un spécialiste.
Techniques de neurostimulation
La stimulation électrique transcutanée
La stimulation électrique transcutanée (TENS) est une technique non invasive de neurostimulation périphérique qui consiste à délivrer des courants électriques pulsés à la surface de la peau. Le patient peut l’utiliser de manière autonome. Malgré la qualité méthodologique faible des études évaluant les TENS dans la douleur neuropathique (26), ce traitement est recommandé en France en raison de son rapport efficacité/sécurité favorable (12).
La stimulation cérébrale non invasive
La stimulation magnétique transcrânienne répétitive (rTMS) du cortex moteur est une technique non invasive de neurostimulation de plus en plus utilisée en analgésie. Plusieurs essais contrôlés randomisés, dont des études françaises de qualité élevée (rTMS neuronaviguée assistée par un robot avec une sonde à double face, une placebo et une active), ont suggéré son efficacité après des séances répétées dans la douleur neuropathique (27). Le niveau de preuve des autres techniques de stimulation cérébrale est plus faible (28).
La neurostimulation invasive
La stimulation de la moelle épinière (SCS) est la technique invasive la plus utilisée pour les douleurs neuropathiques du diabète réfractaires (12). Une électrode est implantée dans l’espace épidural dorsal, délivrant des impulsions électriques qui modulent les circuits de la douleur. Quelques études ouvertes ont indiqué son efficacité dans cette indication.
Recommandations thérapeutiques
Plusieurs recommandations fondées sur les preuves ont été publiées pour le traitement pharmacologique des douleurs neuropathiques, notamment des recommandations françaises (12) et récemment internationales (29).
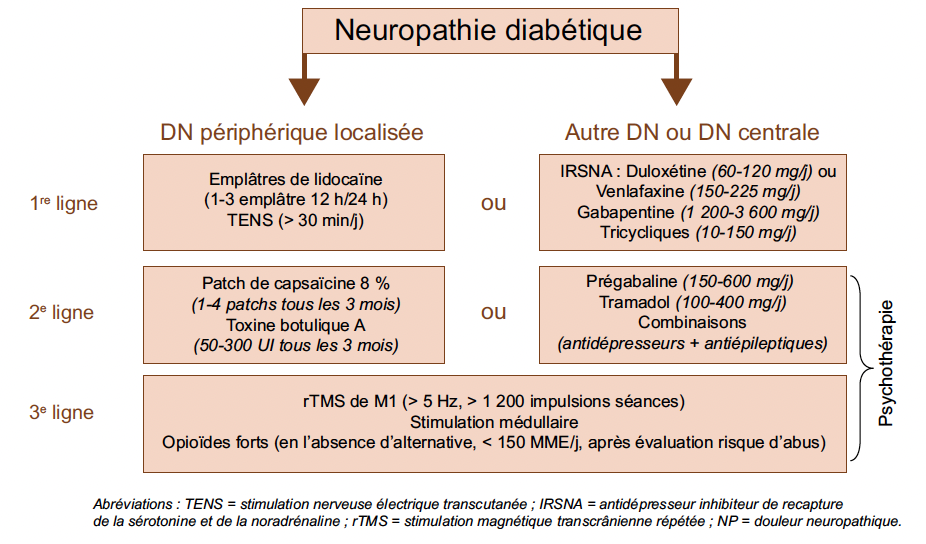
Les recommandations françaises (Fig. 1) font la distinction entre les douleurs neuropathiques périphériques localisées et les autres douleurs neuropathiques. Les recommandations internationales reposent sur une nouvelle méta-analyse portant sur des essais contrôlés contre placebo (29). La différence principale avec les recommandations françaises est qu’elles ne font pas de distinction entre prégabaline et gabapentine, les situant en première intention avec un plan de gestion des risques potentiels d’abus et de mésusage et qu’elles considèrent tous les opiacés, y compris le tramadol, en dernière intention, compte tenu de l’absence de différence en termes de risques addictifs entres les opiacés dits faibles et forts.
Figure 1 – Algorithme thérapeutique pour la prise en charge de la douleur neuropathique de l’adulte (12).
Les Drs Spagna et Nolot déclarent ne pas avoir de liens d’intérêt. Le Pr Attal déclare des conseils scientifiques ou interventions pour Grunenthal, Merz, Medtronic, Pfizer, Viatris.
Bibliographie
1. Finnerup NB, Haroutounian S, Kamerman P et al. Neuropathic pain: an updated grading system for research and clinical practice. Pain 2016 ; 157 : 1599‑606.
2. Scholz J, Finnerup NB, Attal N et al. The IASP classification of chronic pain for ICD-11: chronic neuropathic pain. Pain 2019 ; 160 : 53‑9.
3. Bouhassira D, Attal N, Alchaar H et al. Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain 2005 ; 114 : 29‑36.
4. Truini A, Aleksovska K, Anderson CC et al. Joint European Academy of Neurology-European Pain Federation-Neuropathic Pain Special Interest Group of the International Association for the Study of Pain guidelines on neuropathic pain assessment. Eur J Neurol 2023 ; 30 : 2177-96.
5. Bennett MI, Smith BH, Torrance N, Potter J. The S-LANSS score for identifying pain of predominantly neuropathic origin: validation for use in clinical and postal research. J Pain 2005 ; 6 : 149‑58.
6. Bouhassira D, Lantéri-Minet M, Attal N et al. Prevalence of chronic pain with neuropathic characteristics in the general population. Pain 2008 ; 136 : 380‑7.
7. Freynhagen R, Baron R, Gockel U, Tölle TR. painDETECT: a new screening questionnaire to identify neuropathic components in patients with back pain. Curr Med Res Opin 2006 ; 22 : 1911‑20.
8. Stainforth-Dubois M, McDonald EG. Neuropathie induite par le traitement du diabète associée à une correction soudaine du contrôle glycémique. Can Med Assoc J 2021 ; 193 : E1438‑41.
9. Zaino B, Goel R, Devaragudi S et al. Diabetic neuropathy: Pathogenesis and evolving principles of management. Dis Mon 2023 ; 69 : 101582.
10. Attal N, Bouhassira D. Advances in the treatment of neuropathic pain. Curr Opin Neurol 2021 ; 34 : 631‑7.
11. Attal N, Bouhassira D. Pharmacotherapy of neuropathic pain: which drugs, which treatment algorithms? Pain 2015 ; 156 Suppl 1 : S104‑14.
12. Moisset X, Bouhassira D, Avez Couturier J et al. Pharmacological and non-pharmacological treatments for neuropathic pain: Systematic review and French recommendations. Rev Neurol 2020 ; 176 : 325‑52.
13. Finnerup NB, Attal N, Haroutounian S et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol 2015 ; 14 : 162‑73.
14. Holbech JV, Bach FW, Finnerup NB et al. Imipramine and pregabalin combination for painful polyneuropathy: a randomized controlled trial. Pain 2015 ; 156 : 958‑66.
15. Yalcin I, Choucair-Jaafar N, Benbouzid M et al. Beta(2)-adrenoceptors are critical for antidepressant treatment of neuropathic pain. Ann Neurol 2009 ; 65 : 218‑25.
16. Neuropathic pain in adults: pharmacological management in non-specialist settings. NICE 2020 ; 37.
17. Tambon M, Ponté C, Jouanjus E et al. Gabapentinoid abuse in France: Evidence on health consequences and new points of vigilance. Front Psychiatry 2021 ; 12 : 639780.
18. Tesfaye S, Sloan G, Petrie J et al. Comparison of amitriptyline supplemented with pregabalin, pregabalin supplemented with amitriptyline, and duloxetine supplemented with pregabalin for the treatment of diabetic peripheral neuropathic pain (OPTION-DM): a multicentre, double-blind, randomised crossover trial. Lancet 2022 ; 400 : 680‑90.
19. Pickering G, Voute M, Macian N et al. Effectiveness and safety of 5% lidocaine-medicated plaster on localized neuropathic pain after knee surgery: a randomized, double-blind controlled trial. Pain 2019 ; 160 : 1186‑95.
20. Demant DT, Lund K, Finnerup NB et al. Pain relief with lidocaine 5% patch in localized peripheral neuropathic pain in relation to pain phenotype: a randomised, double-blind, and placebo-controlled, phenotype panel study. Pain 2015 ; 156 : 2234‑44.
21. Backonja M, Wallace MS, Blonsky ER et al. NGX-4010, a high-concentration capsaicin patch, for the treatment of postherpetic neuralgia: a randomised, double-blind study. Lancet Neurol 2008 ; 7 : 1106‑12.
22. Simpson DM, Brown S, Tobias J, NGX-4010 C107 Study Group. Controlled trial of high-concentration capsaicin patch for treatment of painful HIV neuropathy. Neurology 2008 ; 70 : 2305‑13.
23. Simpson DM, Gazda S, Brown S et al. Long-term safety of NGX-4010, a high-concentration capsaicin patch, in patients with peripheral neuropathic pain. J Pain Symptom Manage 2010 ; 39 : 1053‑64.
24. Simpson DM, Robinson-Papp J, Van J et al. Capsaicin 8% Patch in painful diabetic peripheral neuropathy: a randomized, double-blind, placebo-controlled study. J Pain 2017 ; 18 : 42‑53.
25. Spagna A, Attal N. Botulinum toxin A and neuropathic pain: An update. Toxicon 2023 ; 232 : 107208.
26. Gibson W, Wand BM, O’Connell NE. Transcutaneous electrical nerve stimulation (TENS) for neuropathic pain in adults. Cochrane Database Syst Rev 2017 ; 9 : CD011976.
27. Spagna A, Attal N. Pharmacotherapy and noninvasive neurostimulation for neuropathic pain. Presse Med 2024 ; 53 : 104233.
28. Lefaucheur JP, Aleman A, Baeken C et al. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS): An update (2014-2018). Clin Neurophysiol 2020 ; 131 : 474‑528.
29. Soliman N, Moisset X, Ferraro MC et al. Pharmacotherapy and non-invasive neuromodulation for neuropathic pain: a systematic review and meta-analysis. Lancet Neurol 2025 ; 24 : 413‑28.
30. Bouhassira D, Attal N. Personalized treatment of neuropathic pain: Where are we now? Eur J Pain 2023 ; 27 : 1084‑98.